Rozpocznijmy naszą podróż po świecie kwasów, analizując zagadnienia z podręcznika "Chemia Nowej Ery 2" w kontekście testów i zadań.
Czym są kwasy?
Kwasy to związki chemiczne, które w roztworach wodnych dysocjują, oddając jony wodorowe (H+). To właśnie obecność tych jonów odpowiada za charakterystyczne właściwości kwasów. Smak kwasów jest kwaśny (chociaż degustacja kwasów w laboratorium jest surowo zabroniona!), a w kontakcie z metalami często powodują ich korozję.
Dysocjacja kwasowa
Dysocjacja kwasowa to proces rozpadu cząsteczki kwasu na jony w roztworze wodnym. Na przykład, kwas chlorowodorowy (HCl) w wodzie rozkłada się na jon wodorowy (H+) i jon chlorkowy (Cl-). Stopień dysocjacji kwasu wpływa na jego moc - im większy stopień, tym mocniejszy kwas.
Mocne i słabe kwasy
Kwasy dzielimy na mocne i słabe. Mocne kwasy dysocjują w roztworze wodnym praktycznie całkowicie. Przykładami są kwas chlorowodorowy (HCl), kwas siarkowy(VI) (H2SO4) i kwas azotowy(V) (HNO3). Słabe kwasy dysocjują tylko częściowo, np. kwas octowy (CH3COOH) czy kwas węglowy (H2CO3).
Właściwości kwasów
Kwasy posiadają szereg charakterystycznych właściwości. Reagują z zasadami, tworząc sole i wodę (reakcja zobojętniania). Reagują z metalami aktywnymi, wydzielając wodór. Powodują zmiany barwy wskaźników, np. papierek wskaźnikowy uniwersalny barwi się na czerwono.
Reakcje kwasów
Reakcje kwasów są bardzo ważne w chemii. Reakcja zobojętniania to reakcja kwasu z zasadą. Na przykład: HCl + NaOH → NaCl + H2O. Kwas reaguje z zasadą sodową tworząc sól (chlorek sodu) i wodę. Kwasy reagują również z tlenkami metali, dając sole i wodę, np. H2SO4 + CuO → CuSO4 + H2O.
Zastosowania kwasów
Kwasy znajdują szerokie zastosowanie w przemyśle, laboratoriach i życiu codziennym. Kwas siarkowy(VI) (H2SO4) jest używany do produkcji nawozów, detergentów i tworzyw sztucznych. Kwas chlorowodorowy (HCl) stosuje się w przemyśle spożywczym i metalurgicznym. Kwas octowy (CH3COOH), czyli ocet, jest powszechnie używany w kuchni.
Identyfikacja kwasów
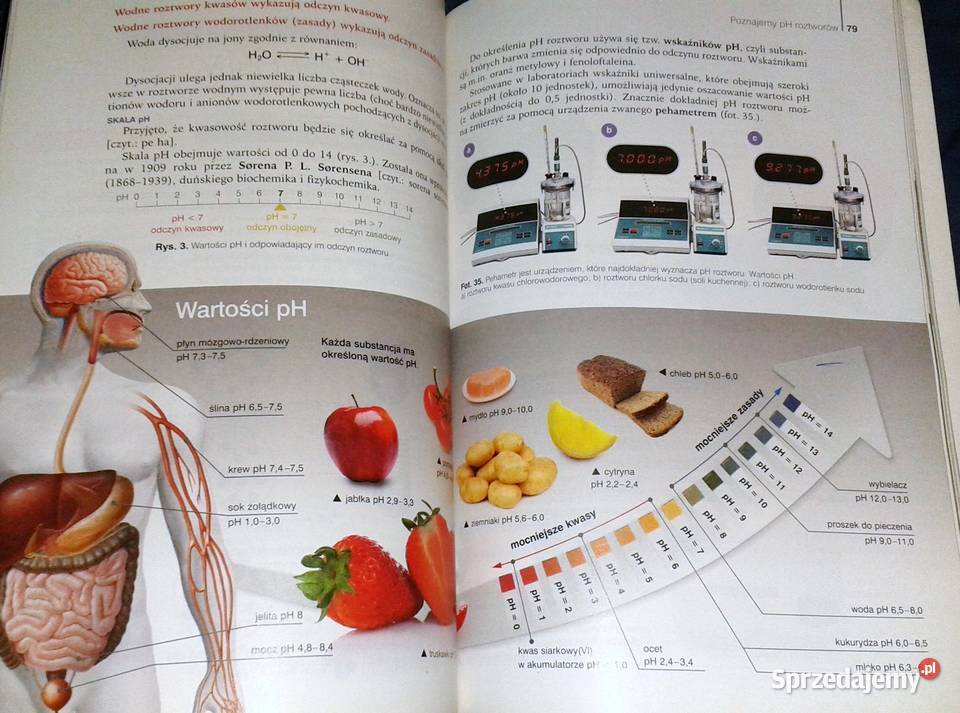
Do identyfikacji kwasów używa się wskaźników, czyli substancji, które zmieniają barwę w zależności od pH roztworu. Papierek wskaźnikowy uniwersalny, oranż metylowy i fenoloftaleina to popularne wskaźniki. pH-metr to urządzenie, które precyzyjnie mierzy pH roztworu.
Przykładowe zadania z testów
W testach z "Chemii Nowej Ery 2" często pojawiają się pytania dotyczące dysocjacji kwasów, identyfikacji kwasów, reakcji kwasów z metalami i zasadami. Ważne jest, aby znać wzory i nazwy popularnych kwasów oraz ich właściwości.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć zagadnienia związane z kwasami. Pamiętaj o regularnej nauce i rozwiązywaniu zadań, aby dobrze przygotować się do testów z chemii!











.jpg)

