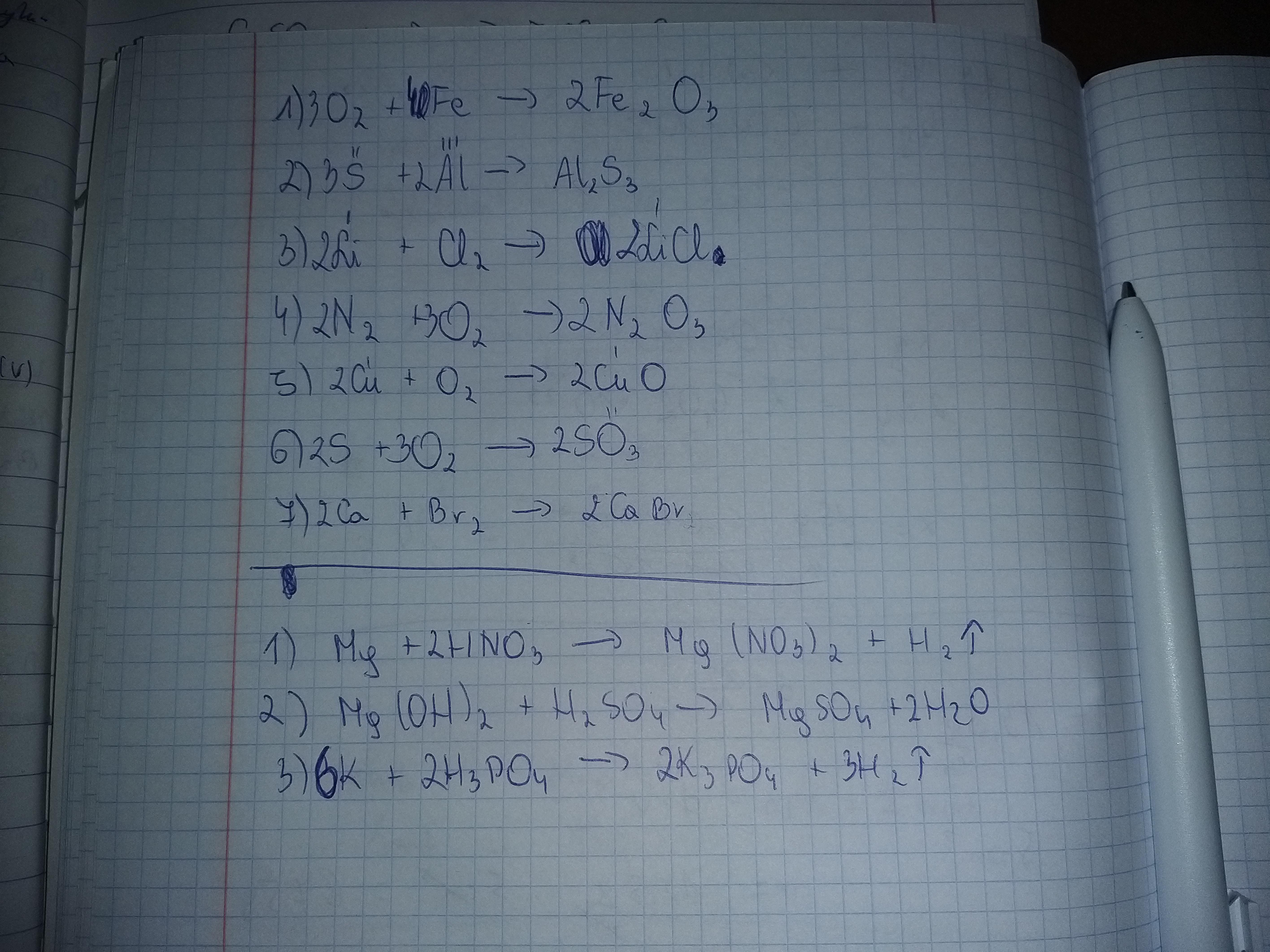Hej! Przygotowujesz się do egzaminu z chemii? Super! Dobieranie współczynników stechiometrycznych może wydawać się trudne, ale spokojnie, razem to ogarniemy. Ten poradnik pomoże Ci zrozumieć i opanować tę umiejętność.
Czym jest dobieranie współczynników?
To proces, w którym ustalamy liczby przed symbolami lub wzorami chemicznymi w równaniu reakcji.
Celem jest zapewnienie, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania.
Czemu to robimy? Prawo zachowania masy!
Metody dobierania współczynników
Istnieje kilka metod. Omówimy dwie najpopularniejsze: metoda prób i błędów oraz metoda algebraiczna.
Metoda prób i błędów (inspekcji)
To najprostsza metoda, idealna do prostych równań. Polega na stopniowym dopasowywaniu współczynników.
Zaczynamy od pierwiastka, który występuje tylko w jednym związku po każdej stronie równania.
Następnie dopasowujemy współczynniki dla pozostałych pierwiastków.
Sprawdźmy przykład: H2 + O2 → H2O
Widzimy, że po lewej stronie mamy 2 atomy tlenu, a po prawej tylko 1. Dopiszmy więc 2 przed H2O.
H2 + O2 → 2H2O
Teraz mamy 4 atomy wodoru po prawej stronie i tylko 2 po lewej. Dopiszmy 2 przed H2.
2H2 + O2 → 2H2O
Gotowe! Równanie jest zbilansowane.
Metoda algebraiczna
Bardziej systematyczna metoda, przydatna do bardziej skomplikowanych równań.
Polega na przypisaniu liter (np. a, b, c, d) jako współczynników do każdego związku w równaniu.
Następnie tworzymy układ równań, w którym liczba atomów każdego pierwiastka po lewej stronie jest równa liczbie atomów po prawej stronie.
Rozwiązujemy układ równań, aby znaleźć wartości a, b, c, d.
Przykład: KMnO4 + HCl → KCl + MnCl2 + H2O + Cl2
Przypisujemy litery: aKMnO4 + bHCl → cKCl + dMnCl2 + eH2O + fCl2
Tworzymy układ równań:
K: a = c
Mn: a = d
O: 4a = e
H: b = 2e
Cl: b = c + 2d + 2f
Ustalmy a = 1. Wtedy c = 1 i d = 1.
Z 4a = e wynika, że e = 4.
Z b = 2e wynika, że b = 8.
Z b = c + 2d + 2f wynika, że 8 = 1 + 2 + 2f, więc 2f = 5, a f = 2.5.
Pomnóżmy wszystko przez 2, żeby pozbyć się ułamków:
a = 2, b = 16, c = 2, d = 2, e = 8, f = 5.
Zatem zbilansowane równanie to:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Wskazówki i triki
Zacznij od pierwiastków, które występują tylko raz po każdej stronie równania.
Jeżeli masz grupę poliatomową (np. SO4), potraktuj ją jako całość, jeśli występuje po obu stronach bez zmian.
Czasami trzeba pomnożyć wszystkie współczynniki przez wspólną liczbę, aby uzyskać najmniejsze możliwe liczby całkowite.
Sprawdź, czy liczba atomów każdego pierwiastka jest taka sama po obu stronach równania. To kluczowe!
Nie bój się próbować! Ćwiczenie czyni mistrza. Im więcej zadań rozwiążesz, tym lepiej to opanujesz.
Typowe błędy
Zmiana indeksów w związkach chemicznych. Pamiętaj, zmieniamy tylko współczynniki, a nie wzory!
Niedokładne liczenie atomów. Zawsze sprawdzaj dwa razy.
Rezygnacja zbyt szybko. Czasami trzeba trochę pokombinować.
Przykładowe zadania do poćwiczenia
1. CH4 + O2 → CO2 + H2O
2. Fe + O2 → Fe2O3
3. C2H6 + O2 → CO2 + H2O
4. KClO3 → KCl + O2
5. Al + H2SO4 → Al2(SO4)3 + H2
Podsumowanie
Dobieranie współczynników stechiometrycznych to ważna umiejętność w chemii.
Pamiętaj o prawie zachowania masy.
Możesz użyć metody prób i błędów lub metody algebraicznej.
Ćwicz regularnie i nie poddawaj się!
Powodzenia na egzaminie! Wierzę w Ciebie!