Witaj! Razem odkryjemy tajemnice atomu i układu okresowego. Przygotuj się na przygodę!
Budowa Atomu - Miniaturowy Układ Słoneczny
Wyobraź sobie atom jak mini układ słoneczny. W centrum jest jądro.
Jądro to jak Słońce. Jest bardzo ciężkie i ma ładunek dodatni.
W jądrze znajdują się protony i neutrony.
Protony to cząstki z ładunkiem dodatnim (+). Myśl o nich jak o małych plusach.
Neutrony są neutralne, bez ładunku (0). To jak neutralni obserwatorzy.
Wokół jądra krążą elektrony. To jak planety krążące wokół Słońca.
Elektrony mają ładunek ujemny (-). Myśl o nich jak o małych minusach.
Elektrony poruszają się po orbitalach. Orbitale to jak ścieżki planet. Każda ścieżka ma swoją pojemność.
Pierwszy orbital może pomieścić tylko dwa elektrony.
Kolejne orbitale mogą pomieścić więcej elektronów (np. 8).
Liczba protonów w jądrze określa, jaki to pierwiastek. To jak numer identyfikacyjny pierwiastka.
Jeśli masz 6 protonów, to zawsze będzie węgiel. Zawsze!
Liczba elektronów w atomie (neutralnym) jest równa liczbie protonów. Plusy i minusy się równoważą.
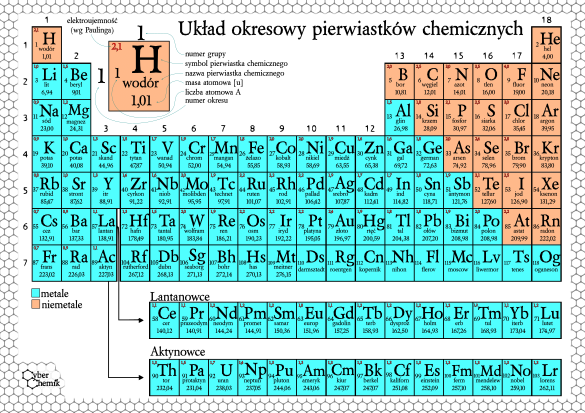
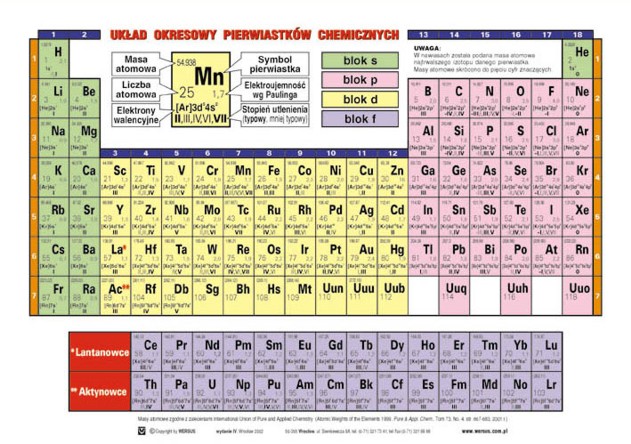
Układ Okresowy Pierwiastków - Mapa Pierwiastków
Układ okresowy to jak mapa wszystkich znanych pierwiastków chemicznych. Jest uporządkowany.
Pierwiastki są ułożone w rzędach (okresach) i kolumnach (grupach).
Okres to rząd poziomy. Liczba okresu mówi nam, ile orbitali zajmują elektrony danego pierwiastka.
Grupa to kolumna pionowa. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne.
To dlatego, że mają tyle samo elektronów na ostatnim orbitalu. To decyduje o tym, jak reagują z innymi pierwiastkami.
Popatrz na sód (Na) i potas (K). Leżą w tej samej grupie (alkaliach). Reagują podobnie, np. z wodą.
Układ okresowy ma swoje "dzielnice". Są metale, niemetale i półmetale.
Metale (większość) są błyszczące, przewodzą prąd i ciepło. To jak metalowe garnki w kuchni.
Niemetale (np. tlen, azot) często są gazami. Nie przewodzą prądu. To jak powietrze, którym oddychamy.
Półmetale mają cechy i metali, i niemetali. Są przydatne w elektronice. To jak krzem w komputerach.
Liczba atomowa to numer pierwiastka w układzie okresowym. Mówi nam, ile jest protonów w jądrze.
Masa atomowa to średnia masa atomu danego pierwiastka. Uwzględnia izotopy.
Sprawdzian - Czas na Podsumowanie!
Pamiętaj: atom ma jądro (protony i neutrony) i elektrony krążące wokół. To jak mini układ słoneczny.
Układ okresowy to mapa pierwiastków. Uporządkowana w okresy i grupy.
Liczba atomowa to liczba protonów. Masa atomowa to średnia masa atomu.
Powodzenia na sprawdzianie! Wykorzystaj swoją wiedzę i wizualizacje.
Jeśli masz 6 protonów, to wiesz że jest to węgiel. Zapamiętaj to!
Zwróć uwagę na położenie pierwiastków w układzie okresowym. To podpowie Ci o ich właściwościach.
Na przykład, pierwiastki w tej samej grupie reagują podobnie.
Nie zapomnij o metalach, niemetalach i półmetalach. To ważne kategorie!
Myśl o metalach jak o garnkach, a o niemetalach jak o gazach w powietrzu.
Pamiętaj, że liczba elektronów na ostatnim orbitalu decyduje o właściwościach chemicznych pierwiastka.
To ona mówi, jak pierwiastek będzie reagował z innymi pierwiastkami. To klucz!
Użyj analogii do układu słonecznego, żeby zapamiętać budowę atomu.
Wyobraź sobie układ okresowy jako grę. Każdy pierwiastek ma swoje miejsce i rolę.
Pamiętaj, nauka to zabawa! Im więcej wizualizujesz, tym łatwiej zapamiętasz.
Teraz jesteś gotowy! Powodzenia!