Hej! Przygotowując się do sprawdzianu z budowy atomu i układu okresowego, wyobraź sobie, że patrzysz na przepis na ciasto. Składniki to protony, neutrony i elektrony, a przepis to nic innego jak układ okresowy pierwiastków! Zaraz zobaczysz, że to wcale nie jest takie straszne.
Budowa Atomu: Miniaturowy Układ Słoneczny
Atom to jak mini układ słoneczny. W centrum masz jądro atomowe, które jest jak Słońce. Jądro składa się z dwóch typów cząstek:
- Protony: Wyobraź sobie, że to cegiełki z plusem (+). One decydują, jaki to w ogóle pierwiastek. Każdy pierwiastek ma inną liczbę protonów. Na przykład, węgiel (C) zawsze ma 6 protonów, a tlen (O) zawsze ma 8. Zmiana liczby protonów? Zmienia się pierwiastek!
- Neutrony: To też cegiełki, ale bez ładunku (0). Razem z protonami budują jądro i dają mu masę. Mogą być w różnych ilościach dla tego samego pierwiastka – wtedy mamy do czynienia z izotopami. Pomyśl o nich jak o różnych odmianach tego samego ciasta: nadal to ciasto, ale z odrobiną innego składnika.
Wokół jądra, jak planety wokół Słońca, krążą elektrony. To cząstki z minusem (-). Elektrony nie krążą po prostu gdzie popadnie, ale po ściśle określonych orbitalach, które tworzą powłoki elektronowe. Wyobraź sobie, że powłoki to takie "piętra" wokół jądra. Pierwsze piętro (powłoka K) może pomieścić tylko 2 elektrony, drugie piętro (powłoka L) maksymalnie 8, trzecie (powłoka M) 18 i tak dalej.
Przykład: Atom węgla (C) ma 6 protonów. Żeby atom był obojętny elektrycznie, musi mieć też 6 elektronów. Dwa elektrony zajmują pierwszą powłokę (K), a pozostałe cztery – drugą (L).
Liczba protonów w jądrze (liczba atomowa) to najważniejsza informacja o pierwiastku. To tak jak numer identyfikacyjny, który mówi nam, z kim mamy do czynienia.
Układ Okresowy Pierwiastków: Mapa Skarbów Pierwiastków
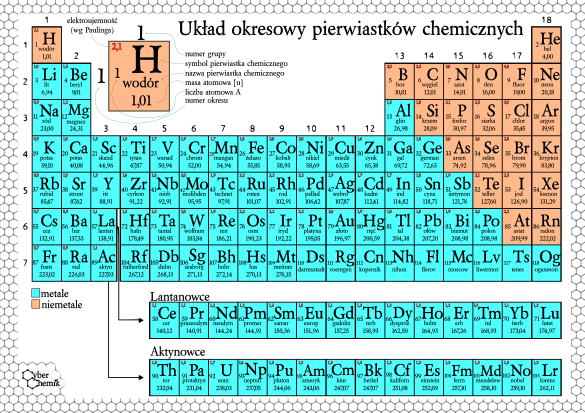
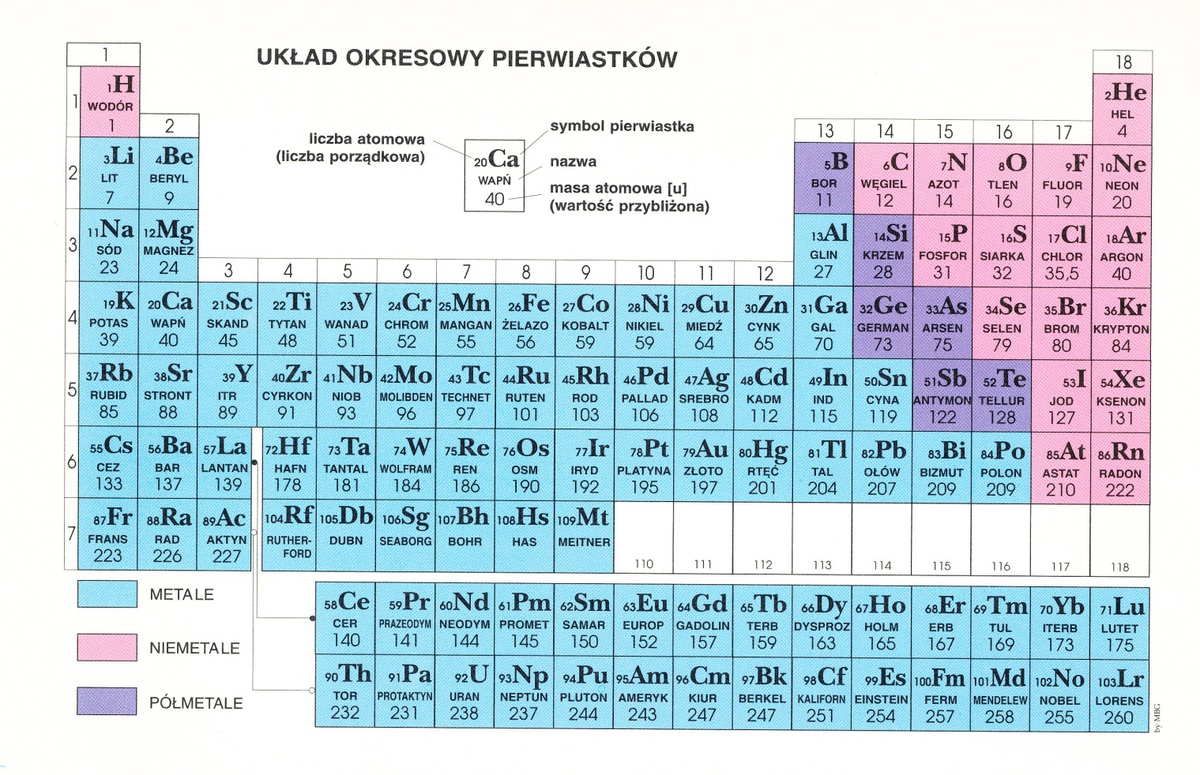
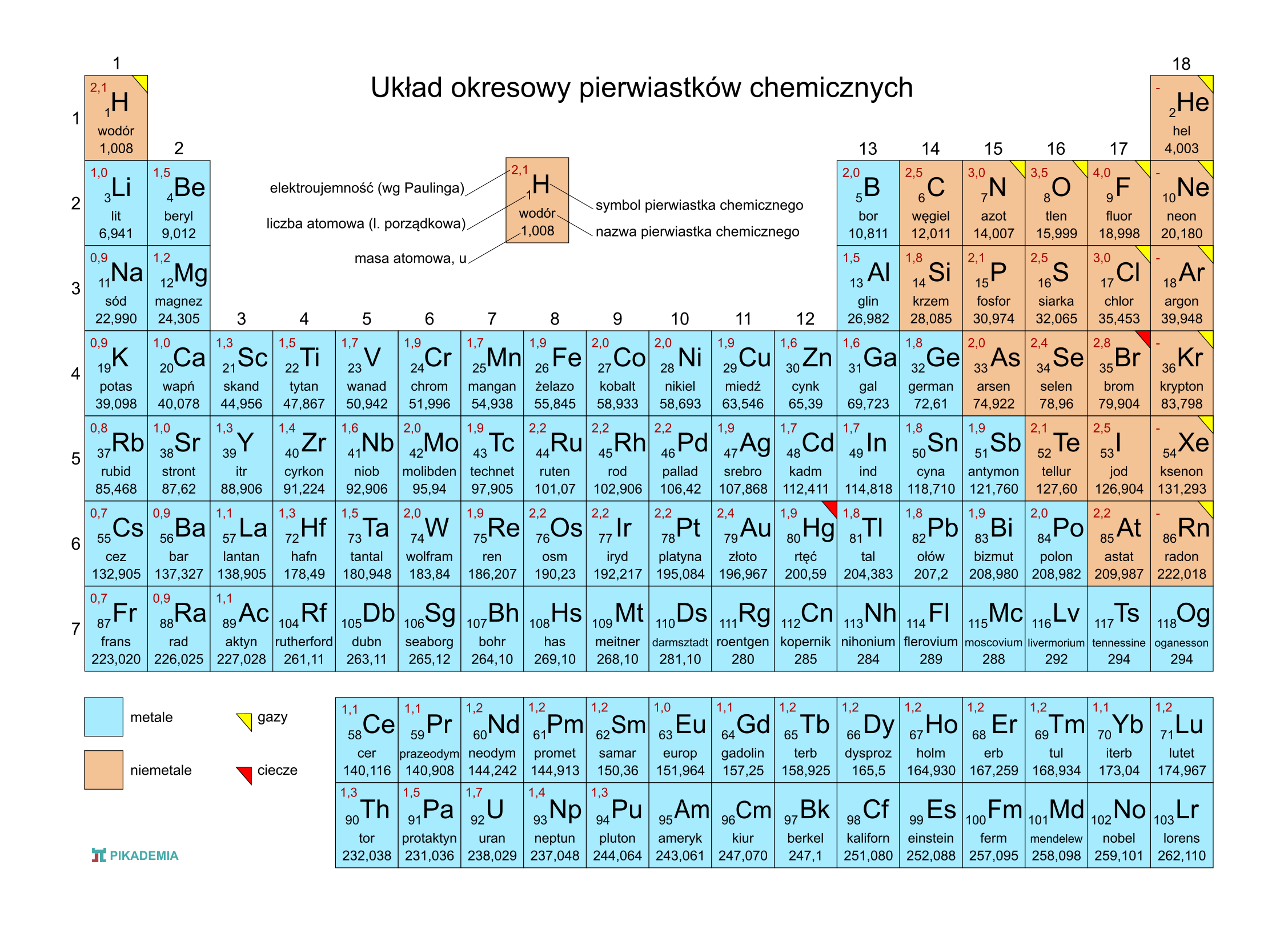
Układ okresowy to tablica, w której pierwiastki są ułożone w określony sposób, zgodnie z rosnącą liczbą atomową. Pomyśl o nim jak o mapie, która pokazuje, gdzie znaleźć konkretny "skarb" (pierwiastek) i jakie ma on właściwości.
Grupy (kolumny) to rodziny pierwiastków, które mają podobne właściwości chemiczne. Dzieje się tak, bo mają tyle samo elektronów na powłoce walencyjnej (ostatniej powłoce). Te elektrony są najważniejsze, bo to one biorą udział w reakcjach chemicznych. Wyobraź sobie, że grupa to banda przyjaciół, którzy lubią robić podobne rzeczy.
Okresy (rzędy) to poziomy układu okresowego. Liczba okresu odpowiada liczbie powłok elektronowych, które ma atom pierwiastka. Na przykład, pierwiastki z trzeciego okresu mają elektrony na trzech powłokach.
Podział Pierwiastków: Metale, Niemetale i Półmetale
Układ okresowy dzieli pierwiastki na trzy główne kategorie:
- Metale: Większość pierwiastków to metale. Są błyszczące, dobrze przewodzą prąd i ciepło, i dają się kuć i ciągnąć. Wyobraź sobie kawałek żelaza – to typowy metal. W układzie okresowym metale znajdują się głównie po lewej stronie.
- Niemetale: Są na ogół matowe, słabo przewodzą prąd i ciepło, i są kruche. Przykładem jest siarka (S) – żółty proszek. Niemetale znajdują się po prawej stronie układu okresowego.
- Półmetale (metaloidy): Mają właściwości pośrednie między metalami i niemetalami. To takie "szare eminencje" – czasem zachowują się jak metale, a czasem jak niemetale. Są ważne w elektronice. Przykładem jest krzem (Si).
Konfiguracja Elektronowa: Jak Elektrony "Mieszkają"
Konfiguracja elektronowa to zapis, który pokazuje, jak elektrony są rozmieszczone na powłokach i orbitalach atomu. To jak adres, który mówi nam, gdzie dokładnie mieszka każdy elektron. Zapis konfiguracji elektronowej pozwala przewidzieć właściwości chemiczne pierwiastka.
Przykład: Konfiguracja elektronowa węgla (C) to 1s2 2s2 2p2. Oznacza to, że ma 2 elektrony na orbitalu 1s, 2 elektrony na orbitalu 2s i 2 elektrony na orbitalu 2p.
Jak Uczyć Się do Sprawdzianu?
Najlepszy sposób to wizualizacja!
- Narysuj sobie atom z protonami, neutronami i elektronami. Oznacz wszystko kolorami.
- Wydrukuj sobie układ okresowy i zaznacz metale, niemetale i półmetale.
- Spróbuj pisać konfiguracje elektronowe dla różnych pierwiastków.
- Rozwiązuj zadania z poprzednich sprawdzianów (jeśli masz taką możliwość).
Pamiętaj, budowa atomu i układ okresowy to podstawa chemii. Zrozumienie tych zagadnień ułatwi Ci dalszą naukę. Powodzenia na sprawdzianie!