Hej! Gotowi na powtórkę z budowy atomu na chemii rozszerzonej? Super! Razem damy radę!
Podstawowe Pojęcia
Zacznijmy od absolutnych podstaw. Pamiętajmy, że wszystko składa się z atomów. To najmniejsza część pierwiastka zachowująca jego właściwości.
Składowe Atomu
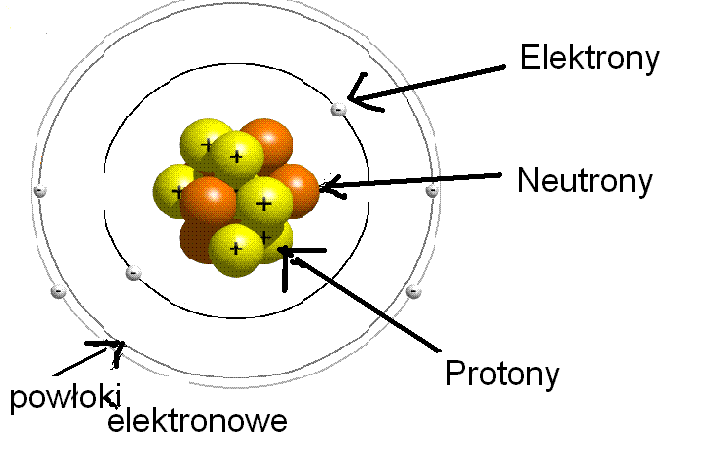
Atom zbudowany jest z trzech podstawowych cząstek: protonów, neutronów i elektronów.
Protony mają ładunek dodatni (+) i znajdują się w jądrze atomowym.
Neutrony są obojętne elektrycznie (nie mają ładunku) i również znajdują się w jądrze.
Elektrony mają ładunek ujemny (-) i krążą wokół jądra na tzw. orbitalach.
Jądro Atomowe
Jądro atomowe zawiera protony i neutrony. To ono decyduje o masie atomu.
Liczba protonów w jądrze to liczba atomowa (Z). To ona identyfikuje pierwiastek!
Liczba masowa (A) to suma protonów i neutronów w jądrze (A = Z + N).
Izotopy
Izotopy to atomy tego samego pierwiastka (ta sama liczba protonów), ale różnią się liczbą neutronów, a więc i liczbą masową.
Na przykład, węgiel-12 (12C) i węgiel-14 (14C) to izotopy węgla.
Konfiguracja Elektronowa
Elektrony nie krążą wokół jądra w sposób losowy. Zajmują określone poziomy energetyczne i orbitale.
Orbitale Atomowe
Orbitale to obszary wokół jądra, gdzie prawdopodobieństwo znalezienia elektronu jest największe.
Mamy różne typy orbitali: s, p, d i f.
Orbital s ma kształt kulisty.
Orbitale p mają kształt hantli.
Orbitale d i f mają bardziej skomplikowane kształty.
Powłoki Elektronowe
Powłoki elektronowe to zbiory orbitali o podobnej energii. Oznacza się je numerami 1, 2, 3… lub literami K, L, M…
Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony.
Druga powłoka (L) może pomieścić maksymalnie 8 elektronów.
Trzecia powłoka (M) może pomieścić maksymalnie 18 elektronów.
Zasady Zapisu Konfiguracji Elektronowej
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i orbitalach.
Stosujemy następujące zasady:
- Zasada Aufbau: elektrony zajmują orbitale o najniższej energii.
- Reguła Hunda: elektrony obsadzają orbitale o tej samej energii pojedynczo, zanim zaczną tworzyć pary.
- Zakaz Pauliego: na jednym orbitalu mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach.
Przykład: Konfiguracja elektronowa tlenu (O, Z=8) to 1s22s22p4.
Zadania - Przykłady i Rozwiązania
Czas na praktykę! Rozwiążemy kilka zadań, żeby utrwalić wiedzę.
Zadanie 1
Określ liczbę protonów, neutronów i elektronów w atomie 56Fe.
Rozwiązanie:
- Żelazo (Fe) ma liczbę atomową Z = 26. Zatem ma 26 protonów.
- Liczba elektronów w atomie obojętnym jest równa liczbie protonów, czyli 26.
- Liczba masowa A = 56. Liczba neutronów N = A - Z = 56 - 26 = 30.
Zadanie 2
Napisz konfigurację elektronową jonu Cl-.
Rozwiązanie:
- Chlor (Cl) ma liczbę atomową Z = 17. Ma więc 17 elektronów.
- Jon Cl- ma jeden elektron więcej, czyli 18 elektronów.
- Konfiguracja elektronowa Cl- to 1s22s22p63s23p6.
Zadanie 3
Który z podanych pierwiastków ma 5 elektronów walencyjnych: Na, P, Cl, Mg?
Rozwiązanie:
- Elektrony walencyjne to elektrony znajdujące się na ostatniej powłoce elektronowej.
- Fosfor (P) ma konfigurację elektronową 1s22s22p63s23p3. Na ostatniej powłoce (3) ma 2 + 3 = 5 elektronów.
- Odpowiedź: P.
Wskazówki Egzaminacyjne
Pamiętaj o definicjach! Zrozumienie podstawowych pojęć to klucz do sukcesu.
Ćwicz pisanie konfiguracji elektronowych. Im więcej przykładów rozwiążesz, tym lepiej.
Zwracaj uwagę na ładunek jonów. To wpływa na liczbę elektronów.
Nie stresuj się! Oddychaj głęboko i skup się na zadaniu.
Podsumowanie
Omówiliśmy dziś:
- Budowę atomu (protony, neutrony, elektrony).
- Jądro atomowe i liczby atomowe oraz masowe.
- Izotopy.
- Konfigurację elektronową i orbitale.
- Zasady Aufbau, Hunda i zakaz Pauliego.
- Rozwiązaliśmy przykładowe zadania.
Powodzenia na egzaminie! Pamiętaj, że wiedza to potęga! Jesteś świetny i dasz radę!