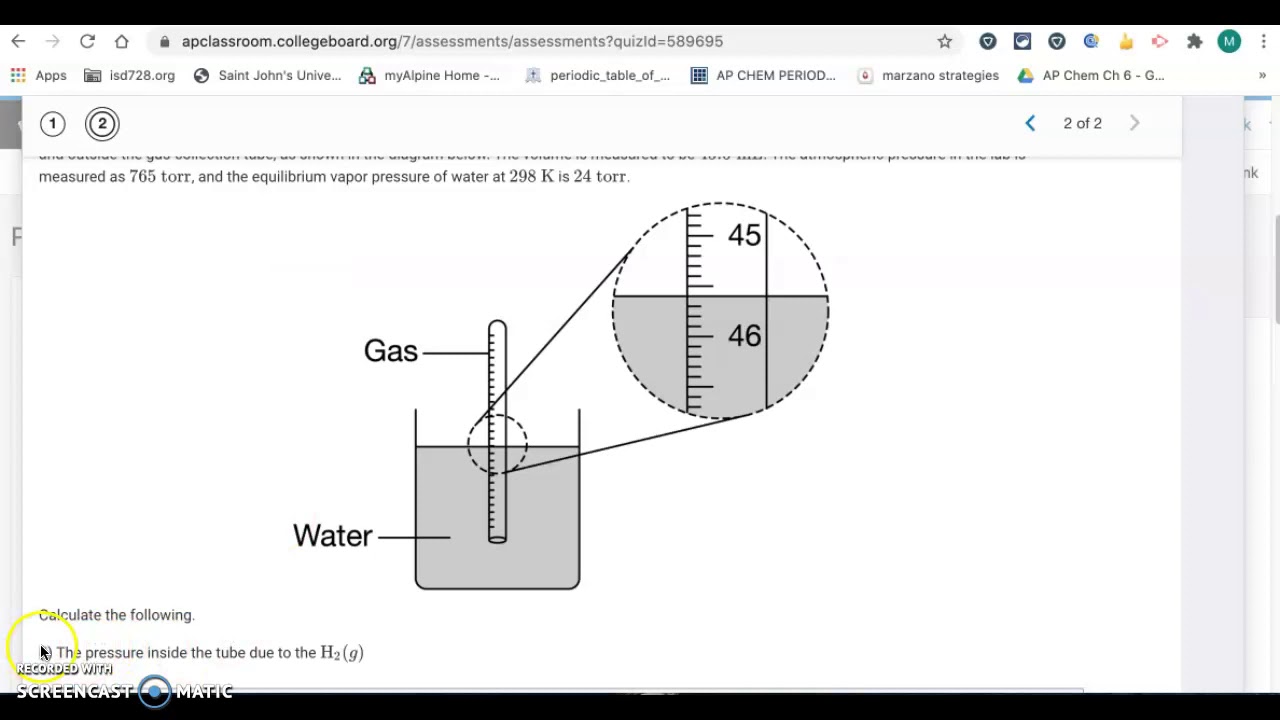
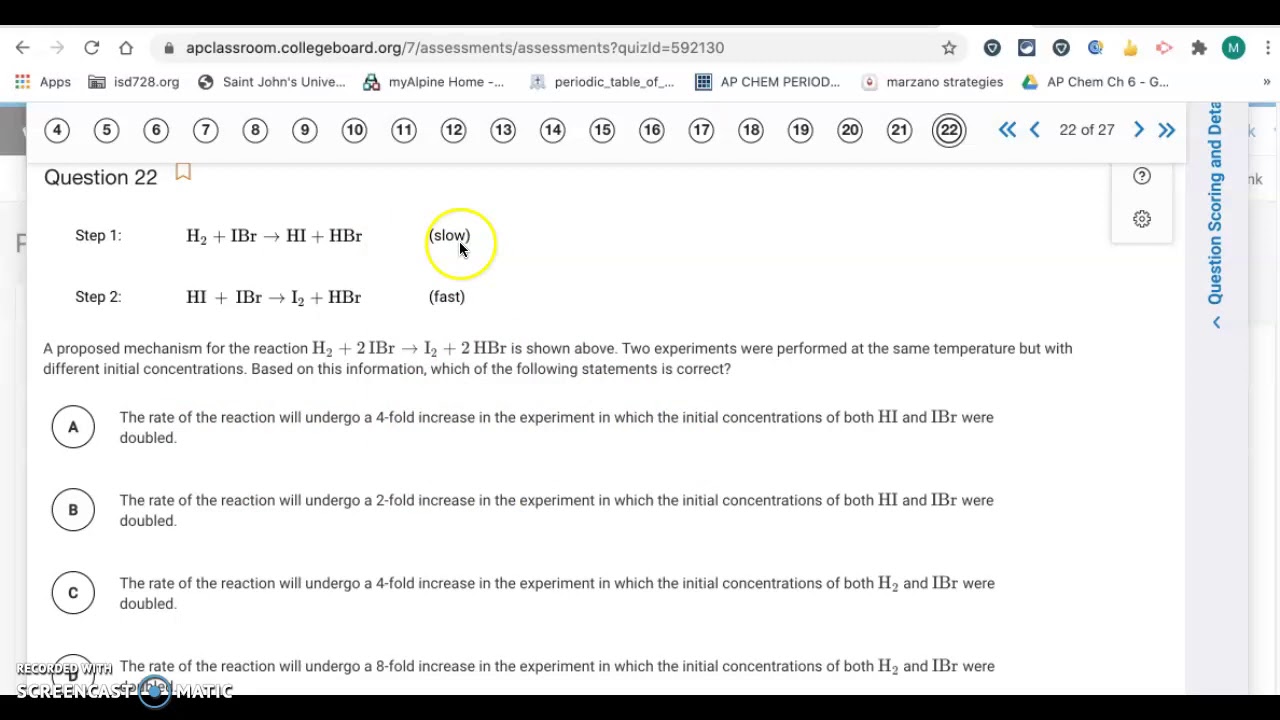
Hej! Zaczynamy rozwiązywać zadania z AP Chemistry, Unit 5. Skupimy się na Progress Check MCQ. Gotowi?
Energia, termochemia i prawa termodynamiki
Pomyśl o energii jak o monecie.
Można nią płacić lub ją otrzymywać. Układ chemiczny może energię oddawać (egzotermiczny) lub pobierać (endotermiczny).
Egzotermiczny: Ogień daje ciepło. Pamiętaj ognisko. Ciepło ucieka!
Endotermiczny: Lód topnieje, pobierając ciepło z otoczenia. Lód robi się zimny!
Prawo Hessa - układanka energii
Prawo Hessa mówi, że zmiana entalpii reakcji jest sumą zmian entalpii poszczególnych etapów.
Wyobraź sobie, że budujesz zamek z LEGO.
Możesz zbudować go od razu lub w kilku etapach.
Całkowita ilość klocków (energia) potrzebna do zbudowania zamku jest taka sama.
Entalpia (ΔH) jest funkcją stanu. To znaczy, zależy tylko od stanu początkowego i końcowego, a nie od drogi.
Jak podróż samochodem. Ważny jest punkt startowy i docelowy.
Kalorymetria – pomiar ciepła
Kalorymetria to metoda pomiaru ciepła.
Wyobraź sobie, że masz termos.
Wkładasz do niego gorącą wodę i zimny metal. Mierzysz temperaturę.
Ciepło przepływa od wody do metalu, aż osiągną temperaturę równowagi.
Kalorymetr mierzy zmiany temperatury.
Ciepło właściwe (c) to ilość energii potrzebna do ogrzania 1 grama substancji o 1 stopień Celsjusza.
Piasek na plaży ma niskie ciepło właściwe. Szybko się nagrzewa!
Woda ma wysokie ciepło właściwe. Wolniej się nagrzewa.
Wiázania chemiczne i energia
Zerwanie wiązania wymaga energii.
To tak, jakbyś musiał użyć siły, żeby złamać patyk.
Powstanie wiązania uwalnia energię.
To tak, jakby patyk sam się złączył, oddając ciepło.
Energia wiązania to energia potrzebna do zerwania jednego mola wiązań w fazie gazowej.
Silniejsze wiązania wymagają więcej energii, żeby je zerwać.
MCQ: Przykładowe zadania
Oto kilka przykładów zadań, z którymi możesz się spotkać:
Zadanie 1: Jaka jest entalpia reakcji dla reakcji A + B → C, jeżeli ΔHf(A) = -100 kJ/mol, ΔHf(B) = -50 kJ/mol, a ΔHf(C) = -200 kJ/mol?
Rozwiązanie: ΔHrxn = ΣΔHf(produkty) - ΣΔHf(substraty). Zatem ΔHrxn = -200 - (-100 - 50) = -50 kJ/mol.
Pamiętaj, że entalpia tworzenia pierwiastków w stanie podstawowym wynosi 0.
Zadanie 2: Reakcja 2H2(g) + O2(g) → 2H2O(g) jest egzotermiczna. Co się stanie z temperaturą otoczenia?
Rozwiązanie: Reakcja egzotermiczna uwalnia ciepło. Temperatura otoczenia wzrośnie.
Pomyśl o ognisku: ciepło ucieka!
Zadanie 3: Jak zmieni się entalpia reakcji, jeśli odwrócimy reakcję?
Rozwiązanie: Znak entalpii zmieni się na przeciwny.
Jeśli reakcja w przód jest egzotermiczna, to reakcja w tył jest endotermiczna.
Wskazówki i triki
Wizualizuj! Rysuj sobie proste schematy reakcji i przepływu energii.
Pamiętaj definicje. Entalpia, entalpia tworzenia, energia wiązania.
Ćwicz, ćwicz, ćwicz! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz materiał.
Zwracaj uwagę na jednostki. Upewnij się, że wszystkie wartości są w odpowiednich jednostkach.
Korzystaj z kalkulatora. Unikniesz błędów obliczeniowych.
Sprawdzaj swoje odpowiedzi. Upewnij się, że Twoja odpowiedź ma sens w kontekście zadania.
Powodzenia na egzaminie!