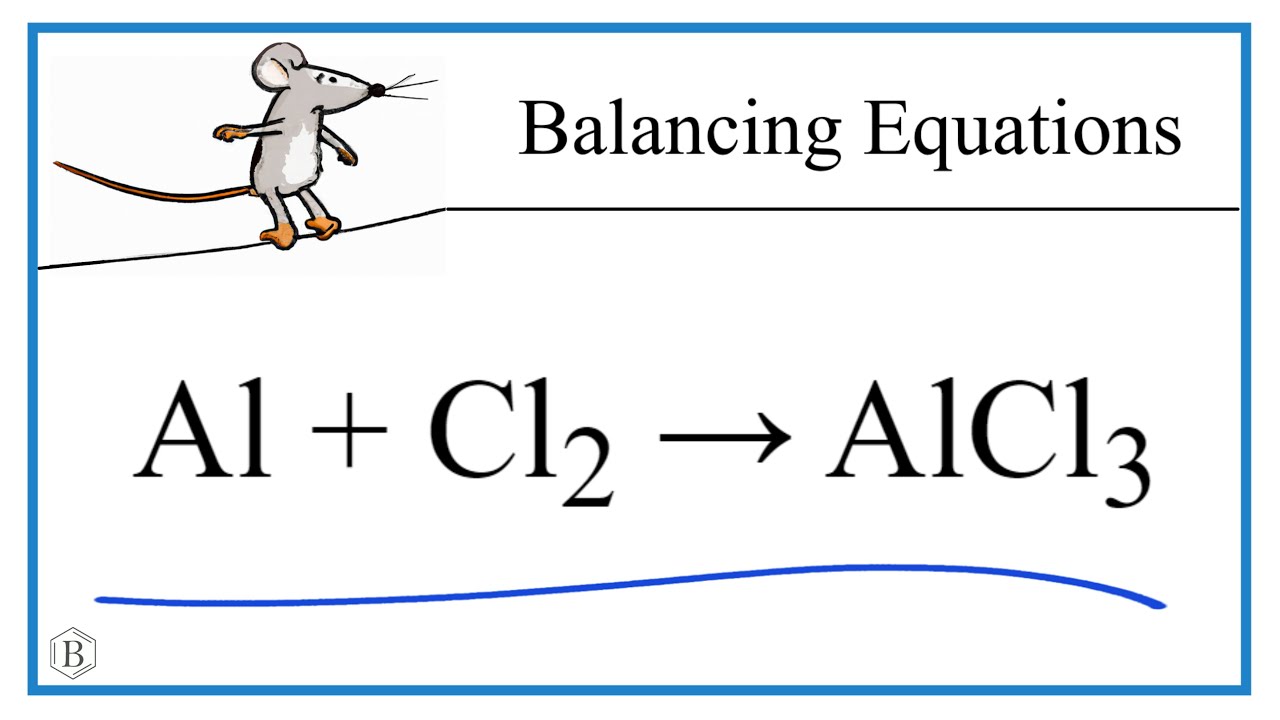
Drodzy nauczyciele chemii!
Porozmawiajmy o równaniu: AlCl2 + AlCl3 → Al + Cl2. To wyzwanie dla uczniów.
Problematyczne równanie reakcji: AlCl2, AlCl3, Al i Cl2
To równanie często sprawia trudności. Dlaczego? AlCl2 rzadko występuje. Mimo to, warto je omówić.
Wyjaśnianie podstaw
Najpierw: co to jest równanie reakcji? Uczymy o zachowaniu masy. Atomy nie giną, ani nie powstają.
Następnie: co oznaczają współczynniki stechiometryczne? Określają proporcje. Uczniowie muszą to rozumieć.
Krok po kroku: Bilansowanie równania
Zacznij od identyfikacji atomów. Wypisz je: Al i Cl.
Policz atomy po obu stronach. Po lewej: Al i Cl w AlCl2 i AlCl3. Po prawej: Al i Cl w Cl2.
Zacznij od najbardziej złożonego związku. Tutaj: AlCl3. Zgadza się?
Spróbuj dopasować chlor. Użyj ułamków, jeśli trzeba. Potem usuń ułamki mnożąc wszystko.
Dopasuj aluminium na końcu. To często najłatwiejsze.
Sprawdź jeszcze raz! Czy wszystko się zgadza? Po obu stronach równania?
Równanie po zbilansowaniu wygląda tak: 3AlCl2 → 2AlCl3 + Al.
Typowe błędy uczniów
Uczniowie zapominają o subskryptach. Mylą je ze współczynnikami.
Nie rozumieją, że współczynniki dotyczą całej cząsteczki. Zmieniają subskrypty, a tego nie wolno!
Zniechęcają się, gdy pojawiają się ułamki. Trzeba ich uspokoić. Pokazać, że to normalne.
Jak zaangażować uczniów?
Użyj modeli atomów. Klocki, kulki, cokolwiek wizualnego.
Wykorzystaj interaktywne symulacje. Wiele jest dostępnych online.
Zorganizuj zawody w bilansowaniu równań. Kto pierwszy, ten lepszy!
Stwórz zagadki chemiczne. Równania jako część większej układanki.
Opowiedz historię. Dlaczego bilansowanie jest ważne? Co by się stało, gdyby go nie było?
AlCl2: Dlaczego jest problematyczny?
AlCl2 jest nietypowy. Normalnie aluminium tworzy związki na +3 stopniu utlenienia.
AlCl2 może istnieć w specyficznych warunkach. Ale jest bardzo reaktywny. Szybko się przekształca.
Warto o tym wspomnieć. Podkreślić, że chemia ma wyjątki.
Inne przykłady bilansowania
Pokaż proste równania. Potem stopniowo zwiększaj trudność.
Zacznij od spalania węglowodorów. To dobry punkt startowy.
Przejdź do reakcji redoks. Tam liczenie elektronów jest kluczowe.
Wykorzystaj różne typy reakcji. Synteza, analiza, wymiana.
Podsumowanie
Bilansowanie równań to fundament chemii. Wymaga praktyki i cierpliwości.
Wyjaśnij podstawy jasno. Użyj wizualizacji. Bądź cierpliwy dla uczniów.
Nie bój się trudnych przykładów. AlCl2 + AlCl3 → Al + Cl2 może być dobrą lekcją.
Pamiętaj: zrozumienie, a nie tylko zapamiętywanie. To klucz do sukcesu.
Powodzenia w nauczaniu!