Dzisiaj omówimy typ wiązania występującego w chlorku sodu (NaCl). Chlorek sodu, znany również jako sól kuchenna, jest doskonałym przykładem związku jonowego. Zrozumienie tego wiązania jest kluczowe dla uczniów.
Wiązanie Jonowe w Chlorku Sodu
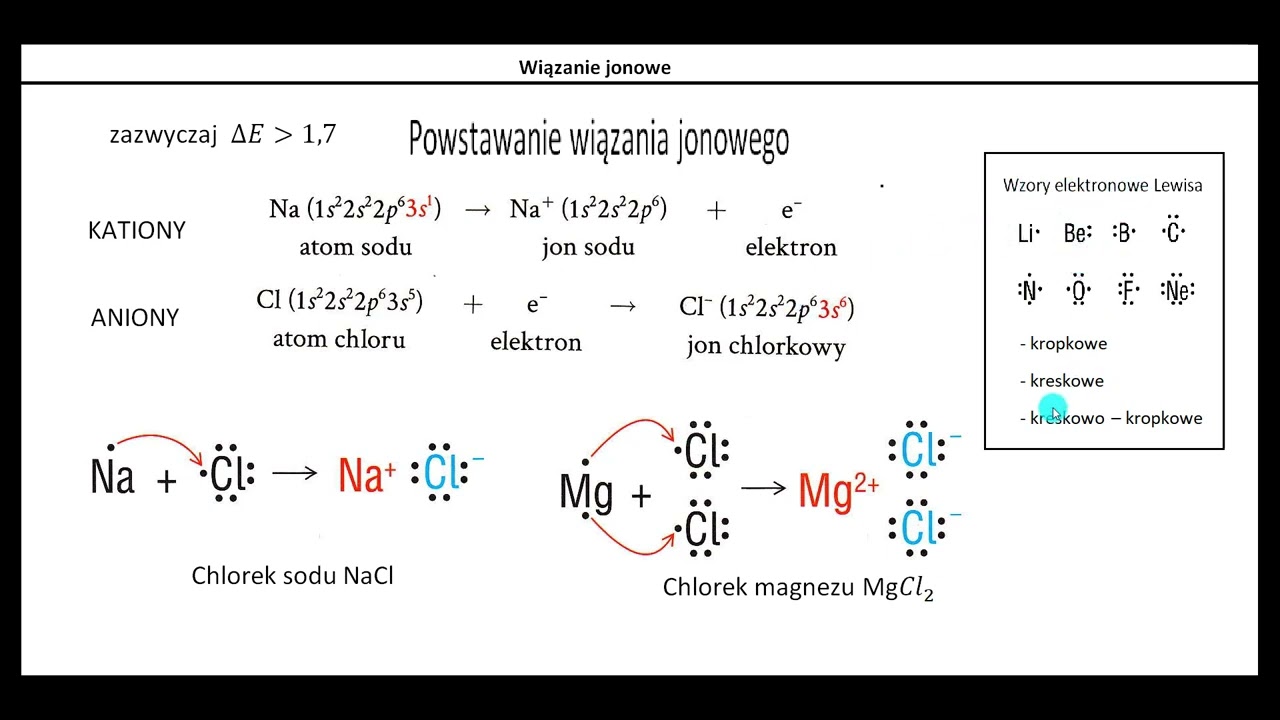
Wiązanie jonowe powstaje między atomami o dużej różnicy elektroujemności. To przeniesienie elektronów, a nie ich uwspólnianie. W przypadku chlorku sodu mamy do czynienia z interakcją między sodem (Na) i chlorem (Cl).
Atom sodu ma jeden elektron walencyjny. Ten elektron chętnie oddaje. Atom chloru ma siedem elektronów walencyjnych. On z kolei chętnie przyjmuje jeden elektron. Oddanie elektronu przez sód i przyjęcie go przez chlor prowadzi do powstania jonów.
Sód, po oddaniu elektronu, staje się jonem dodatnim (kationem). Otrzymuje ładunek +1 (Na+). Chlor, po przyjęciu elektronu, staje się jonem ujemnym (anionem). Otrzymuje ładunek -1 (Cl-). Powstałe jony o przeciwnych ładunkach przyciągają się elektrostatycznie.
Siła przyciągania elektrostatycznego między jonami Na+ i Cl- tworzy wiązanie jonowe. To wiązanie jest silne. Utrzymuje jony razem w strukturze krystalicznej. Z tego powodu chlorek sodu w temperaturze pokojowej występuje w postaci stałej.
Jak Wyjaśnić Wiązanie Jonowe Uczniom?
Używaj prostych analogii. Wyobraź sobie dwa dzieci, jedno ma zabawkę, której nie chce, a drugie jej bardzo potrzebuje. Dziecko, które oddaje zabawkę, staje się "szczęśliwe", a dziecko, które ją otrzymuje, również jest "szczęśliwe". Podobnie sód "oddaje" elektron chlorowi, tworząc stabilne jony.
Stosuj modele wizualne. Narysuj atomy sodu i chloru z elektronami walencyjnymi. Pokaż proces przenoszenia elektronu. Wizualizacja ułatwia zrozumienie. Można użyć kolorowych kulek lub magnesów, aby przedstawić elektrony i jądra atomowe.
Wykorzystaj doświadczenia. Rozpuszczanie chlorku sodu w wodzie to dobry przykład. Wyjaśnij, że woda "rozrywa" wiązanie jonowe. Uwalnia jony Na+ i Cl- do roztworu. Można to zademonstrować za pomocą przewodnictwa elektrycznego.
Pamiętaj o stopniowym wprowadzaniu pojęć. Najpierw omów strukturę atomu. Następnie pojęcie elektroujemności. Dopiero potem wyjaśnij proces powstawania wiązania jonowego. Stopniowe budowanie wiedzy jest kluczowe.
Typowe Błędy i Jak Im Zapobiegać
Częstym błędem jest mylenie wiązania jonowego z kowalencyjnym. Podkreśl różnicę między przenoszeniem a uwspólnianiem elektronów. W wiązaniu jonowym elektrony są *przenoszone*, a w kowalencyjnym *uwspólniane*.
Uczniowie mogą myśleć, że wiązanie jonowe to fizyczne "trzymanie się" atomów. Wyjaśnij, że to siła elektrostatyczna utrzymuje jony razem. Podkreśl charakter elektrostatyczny przyciągania między jonami.
Kolejny błąd to mylenie atomów z jonami. Zwróć uwagę, że sód (Na) to atom obojętny. Sód w chlorku sodu występuje jako jon sodu (Na+). Analogicznie dla chloru.
Unikaj uproszczeń, które mogą wprowadzać w błąd. Na przykład, nie mów, że sód "chce" oddać elektron. Lepiej wyjaśnić, że oddanie elektronu prowadzi do uzyskania konfiguracji elektronowej gazu szlachetnego. To daje większą stabilność.
Uatrakcyjnianie Nauki o Wiązaniach Jonowych
Gry i quizy mogą pomóc w utrwaleniu wiedzy. Stwórz quiz online, w którym uczniowie będą identyfikować związki jonowe. Można użyć platform takich jak Kahoot! lub Quizizz.
Zorganizuj modelowanie wiązań jonowych. Uczniowie mogą budować modele chlorku sodu z koralików lub plasteliny. To aktywne uczenie się. Wzmacnia zrozumienie struktury krystalicznej.
Zastosuj analogie z życia codziennego. Porównaj wiązanie jonowe do magnesów. Magnesy o przeciwnych biegunach się przyciągają. Podobnie jony o przeciwnych ładunkach.
Wykorzystaj filmy edukacyjne i animacje. Istnieje wiele zasobów online, które wizualizują proces tworzenia wiązania jonowego. To pomaga uczniom zobaczyć, co dzieje się na poziomie atomowym.
Zadawaj pytania problemowe. Na przykład: "Dlaczego chlorek sodu przewodzi prąd w roztworze, a nie w stanie stałym?". To zmusza uczniów do myślenia i analizowania.
Chlorek sodu to doskonały przykład do nauki o wiązaniach jonowych. Zastosowanie odpowiednich metod i narzędzi pozwoli uczniom na dogłębne zrozumienie tego ważnego zagadnienia chemicznego. Pamiętaj o cierpliwości i dostosowywaniu tempa nauki do potrzeb uczniów.