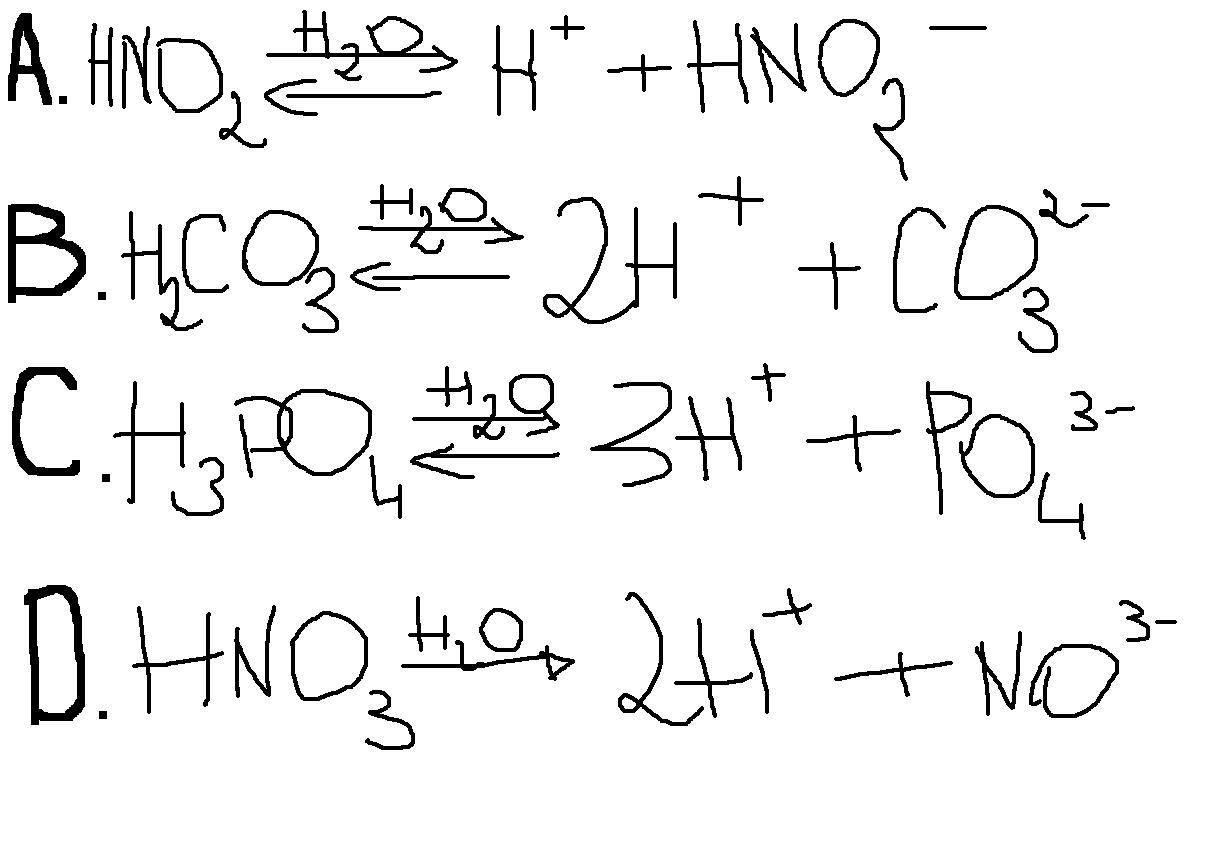Zajmiemy się teraz dysocjacją kwasu azotowego(V). Jest to temat z chemii, który często sprawia trudności. Wyjaśnimy go krok po kroku.
Co to jest dysocjacja?
Dysocjacja to rozpad związku chemicznego na jony. Zachodzi on pod wpływem rozpuszczalnika, np. wody.
Jony to atomy lub grupy atomów posiadające ładunek elektryczny. Mogą być dodatnie (kationy) lub ujemne (aniony).
Dysocjacja elektrolityczna dotyczy związków jonowych i kowalencyjnych spolaryzowanych. Kwas azotowy(V) jest związkiem kowalencyjnym spolaryzowanym.
Kwas azotowy(V) - charakterystyka
Kwas azotowy(V), o wzorze HNO3, jest mocnym kwasem. Oznacza to, że w wodzie dysocjuje praktycznie całkowicie.
Jest to ciecz bezbarwna. Ma silne właściwości utleniające.
Stężony kwas azotowy(V) dymi na powietrzu. Jest to spowodowane wydzielaniem się tlenków azotu.
Zastosowania kwasu azotowego(V)
Kwas azotowy(V) ma szerokie zastosowanie. Używa się go np. do produkcji nawozów sztucznych.
Jest również wykorzystywany w przemyśle farmaceutycznym. Służy do wytwarzania leków.
Stosuje się go także do produkcji materiałów wybuchowych. Np. nitrogliceryny.
Równanie dysocjacji kwasu azotowego(V)
Teraz zapiszemy równanie dysocjacji HNO3. Pamiętajmy, że jest to mocny kwas.
Dysocjacja zachodzi w wodzie. W wyniku dysocjacji powstają jony.
Kwas azotowy(V) dysocjuje na jon wodorowy (H+) i jon azotanowy(V) (NO3-).
Równanie dysocjacji wygląda następująco:
HNO3 → H+ + NO3-
Strzałka w równaniu wskazuje kierunek reakcji. Ponieważ jest to mocny kwas, dysocjacja zachodzi w jednym kierunku.
Wyjaśnienie równania
HNO3 to wzór kwasu azotowego(V).
H+ to jon wodorowy. Odpowiada za kwasowe właściwości roztworu.
NO3- to jon azotanowy(V). Jest to anion pochodzący od kwasu azotowego(V).
Przykłady błędnych zapisów
Często spotykane błędy to:
- HNO3 ⇌ H+ + NO3- (strzałka w obie strony - równowaga dotyczy słabych kwasów)
- HNO3 → H- + NO3+ (nieprawidłowe ładunki jonów)
- HNO3 → H2+ + NO2- (nieprawidłowy rozpad cząsteczki)
Pamiętaj, aby zwracać uwagę na kierunek reakcji i ładunki jonów.
Dlaczego to jest ważne?
Zrozumienie dysocjacji kwasów jest kluczowe. Pozwala przewidywać właściwości roztworów.
Znajomość dysocjacji pomaga w obliczeniach stechiometrycznych. Jest to ważne w analizie chemicznej.
Dysocjacja ma wpływ na wiele procesów chemicznych i biologicznych. Np. na pH roztworów.
Podsumowanie
Kwas azotowy(V) jest mocnym kwasem. W wodzie dysocjuje na jony H+ i NO3-.
Równanie dysocjacji: HNO3 → H+ + NO3-
Pamiętaj o prawidłowym zapisie równania. Zwróć uwagę na kierunek reakcji i ładunki jonów.
Zrozumienie dysocjacji jest ważne w chemii. Pozwala na przewidywanie właściwości roztworów i obliczenia stechiometryczne.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć dysocjację kwasu azotowego(V).