Drodzy nauczyciele chemii!
Przed Wami wyzwanie – przekazanie wiedzy na temat wzorów sumarycznych i strukturalnych kwasów. To fundament zrozumienia chemii organicznej i nieorganicznej. Skuteczna nauka tego zagadnienia pozwoli uczniom lepiej zrozumieć właściwości i reakcje kwasów.
Wprowadzenie do wzorów kwasów
Zacznijmy od podstaw. Wzór sumaryczny informuje nas o liczbie i rodzaju atomów w cząsteczce. Jest to najprostszy sposób przedstawienia składu związku chemicznego. Wzór strukturalny pokazuje, jak atomy są połączone ze sobą w cząsteczce, uwzględniając wiązania chemiczne. Pozwala to na wizualizację struktury przestrzennej i zrozumienie zależności między budową a właściwościami.
Jak wyjaśnić wzór sumaryczny kwasu?
W przypadku kwasów, wzór sumaryczny informuje nas o ilości atomów wodoru (H), które mogą dysocjować, oraz o reszcie kwasowej. Na przykład, kwas siarkowy(VI) ma wzór sumaryczny H2SO4. Oznacza to, że w cząsteczce znajdują się dwa atomy wodoru, jeden atom siarki i cztery atomy tlenu. Wyjaśnij uczniom, że liczba atomów wodoru, które mogą odłączyć się jako jony wodorowe (H+), decyduje o kwasowości.
Wzór strukturalny – klucz do zrozumienia
Wzór strukturalny jest bardziej szczegółowy. Pokazuje, jak atomy są połączone wiązaniami kowalencyjnymi. Używaj różnych notacji: kreskowych (gdzie kreska oznacza wiązanie), uproszczonych (bez rysowania atomów węgla i wodoru w związkach organicznych) i przestrzennych (np. kliny i kreski przerywane). W przypadku kwasów organicznych, podkreśl obecność grupy karboksylowej (-COOH), która jest odpowiedzialna za właściwości kwasowe.
Typowe błędy i nieporozumienia
Uczniowie często mylą wzór sumaryczny ze strukturalnym. Musisz wyraźnie pokazać różnicę. Wyjaśnij, że ten sam wzór sumaryczny może odpowiadać różnym wzorom strukturalnym (izomeria). Częstym błędem jest również nieprawidłowe rysowanie wiązań we wzorach strukturalnych, zwłaszcza w przypadku kwasów organicznych. Należy zwracać uwagę na poprawność rysowania wiązań, uwzględniając wartościowość atomów. Sprawdź, czy uczniowie rozumieją pojęcie grupy funkcyjnej (np. grupy karboksylowej).
Praktyczne wskazówki dla nauczyciela
Używaj modeli molekularnych, aby uczniowie mogli wizualizować strukturę cząsteczek. Pokaż, jak wzór strukturalny odzwierciedla trójwymiarową budowę. Stosuj różne metody reprezentacji wzorów strukturalnych (kreskowe, uproszczone, przestrzenne) i tłumacz, kiedy która jest najbardziej odpowiednia. Wykorzystuj interaktywne symulacje i programy komputerowe do modelowania cząsteczek.
Jak uatrakcyjnić lekcję?
Zorganizuj konkurs na najdokładniejsze i najszybsze narysowanie wzoru strukturalnego. Możesz wykorzystać kartki samoprzylepne, na których uczniowie będą rysować wzory, a następnie umieszczać je na tablicy. Przeprowadź doświadczenie, w którym uczniowie będą identyfikować kwasy na podstawie ich właściwości, a następnie zapisywać ich wzory. Wykorzystaj quizy i gry online do utrwalenia wiedzy. Opracuj zadania problemowe, w których uczniowie będą musieli przewidzieć właściwości kwasu na podstawie jego wzoru strukturalnego.
Użyj przykładów z życia codziennego. Pokaż, jak kwasy są wykorzystywane w przemyśle spożywczym (np. kwas cytrynowy), w rolnictwie (np. nawozy) i w medycynie (np. leki). Wyjaśnij, jak znajomość wzorów kwasów pomaga w zrozumieniu procesów zachodzących w organizmie człowieka, np. trawienia.
Przykłady kwasów i ich wzorów
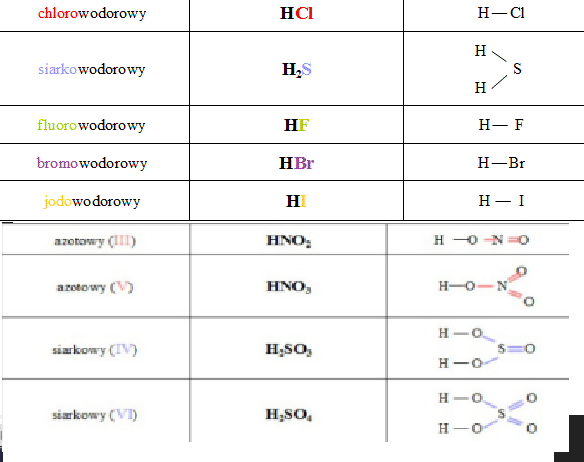
Kwas solny (HCl):
* Wzór sumaryczny: HCl
* Wzór strukturalny: H-Cl
Kwas siarkowy(VI) (H2SO4):
* Wzór sumaryczny: H2SO4
* Wzór strukturalny: HO-S(O)2-OH (grupa centralna S związana podwójnymi wiązaniami z dwoma atomami O i pojedynczymi z dwoma grupami OH)
Kwas azotowy(V) (HNO3):
* Wzór sumaryczny: HNO3
* Wzór strukturalny: HO-N(O)2 (grupa centralna N związana podwójnym wiązaniem z jednym atomem O i pojedynczymi wiązaniami z atomem O i grupą OH)
Kwas octowy (CH3COOH):
* Wzór sumaryczny: CH3COOH
* Wzór strukturalny: CH3-C(O)-OH
Podsumowanie
Opanowanie umiejętności pisania wzorów sumarycznych i strukturalnych kwasów jest kluczowe dla zrozumienia dalszych zagadnień chemii. Stosuj różnorodne metody nauczania, wykorzystuj pomoce wizualne i angażuj uczniów w aktywne rozwiązywanie problemów. Pamiętaj o korygowaniu typowych błędów i nieporozumień. Powodzenia!