Chemia to nauka o materii i jej właściwościach, a także o tym, jak materia ulega zmianom. Jednym z kluczowych aspektów chemii jest zrozumienie różnych rodzajów związków, w tym kwasów. Rozróżniamy dwa główne typy kwasów: kwasy tlenowe i kwasy beztlenowe. Zrozumienie ich struktury i wzorów jest podstawą do dalszej nauki chemii.
Kwasy Beztlenowe
Kwasy beztlenowe to takie kwasy, które w swojej strukturze nie zawierają atomów tlenu. Są to roztwory wodne związków chemicznych, w których atom wodoru łączy się bezpośrednio z atomem niemetalu. Te niemetale to najczęściej fluor (F), chlor (Cl), brom (Br), jod (I) oraz siarka (S).
Tworzenie wzoru kwasu beztlenowego jest dość proste. Zaczynamy od symbolu wodoru (H), a następnie dodajemy symbol niemetalu. Ważne jest, aby uwzględnić wartościowość obu pierwiastków. Wodór zawsze ma wartościowość I. Niemetale natomiast mogą mieć różne wartościowości, ale w kwasach beztlenowych często przyjmują swoją maksymalną wartościowość ujemną.
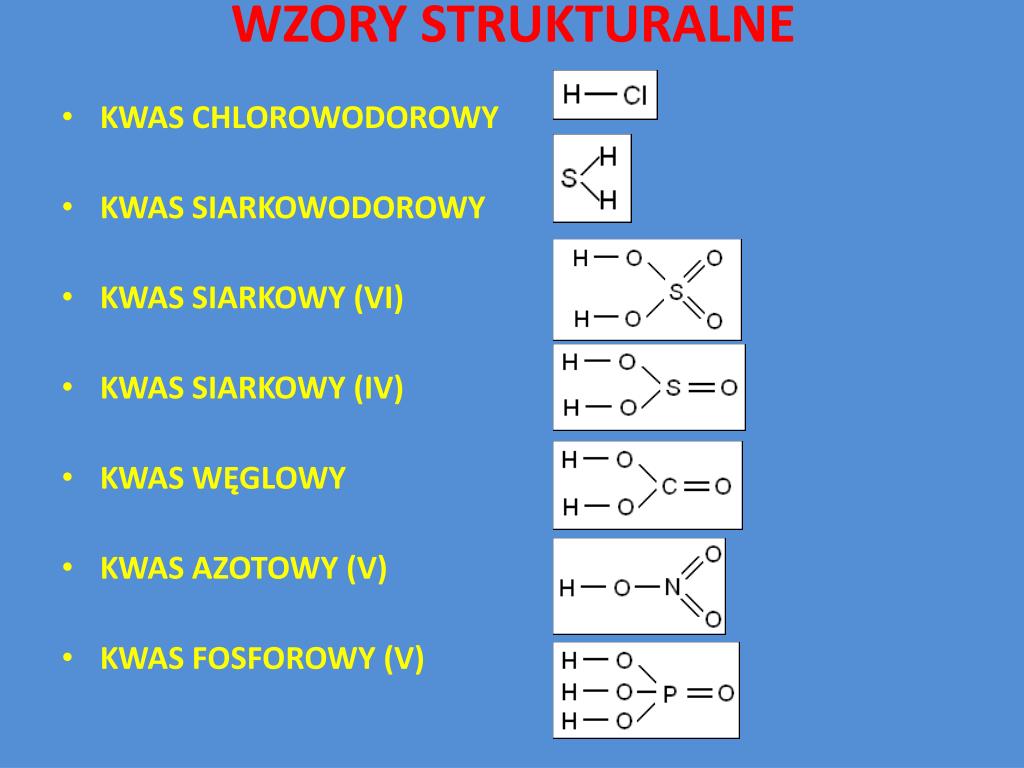
Na przykład, aby napisać wzór kwasu chlorowodorowego, wiemy, że wodór ma wartościowość I, a chlor w tym przypadku również ma wartościowość I (ponieważ dąży do oktetu elektronowego). Dlatego wzór kwasu chlorowodorowego to HCl. Inny przykład to kwas siarkowodorowy. Wodór ma wartościowość I, a siarka w tym kwasie ma wartościowość II. Wzór kwasu siarkowodorowego to zatem H2S. Pamiętaj, że indeks dolny wskazuje ilość atomów danego pierwiastka w cząsteczce.
Przykłady Kwasów Beztlenowych
Oto kilka przykładów kwasów beztlenowych wraz z ich nazwami i wzorami:
- Kwas fluorowodorowy: HF
- Kwas chlorowodorowy: HCl (często nazywany kwasem solnym)
- Kwas bromowodorowy: HBr
- Kwas jodowodorowy: HI
- Kwas siarkowodorowy: H2S
Kwasy Tlenowe
Kwasy tlenowe, w przeciwieństwie do kwasów beztlenowych, zawierają w swojej strukturze atomy tlenu. Są one bardziej złożone niż kwasy beztlenowe, ponieważ składają się z atomów wodoru, tlenu i niemetalu (tzw. pierwiastek centralny). Kwasy tlenowe powstają z tlenków kwasowych (bezwodników kwasowych) w reakcji z wodą.
Tworzenie wzoru kwasu tlenowego wymaga znajomości wartościowości pierwiastka centralnego oraz liczby atomów tlenu. Zazwyczaj zaczynamy od napisania symbolu wodoru (H), następnie symbolu pierwiastka centralnego (np. S dla siarki, N dla azotu, C dla węgla), a na końcu symbolu tlenu (O). Następnie należy dobrać odpowiednie indeksy dolne, aby cała cząsteczka była elektrycznie obojętna.
Na przykład, weźmy pod uwagę kwas siarkowy(VI). Siarka (S) jest pierwiastkiem centralnym, a jej wartościowość wynosi VI. Tlen (O) ma wartościowość II, a wodór (H) ma wartościowość I. Wzór kwasu siarkowego(VI) to H2SO4. Dwa atomy wodoru (2 x +I = +2) neutralizują sześć jednostek ujemnych pochodzących od czterech atomów tlenu (4 x -II = -8) w połączeniu z sześcioma jednostkami dodatnimi od siarki (+VI), dając cząsteczkę obojętną.
Wiele niemetali może tworzyć kilka różnych kwasów tlenowych, różniących się liczbą atomów tlenu. Nazwy tych kwasów różnią się przedrostkami i przyrostkami, które wskazują na stopień utlenienia pierwiastka centralnego. Przykładowo, kwas azotowy(III) ma wzór HNO2, a kwas azotowy(V) ma wzór HNO3.
Przykłady Kwasów Tlenowych
Oto kilka przykładów kwasów tlenowych wraz z ich nazwami i wzorami:
- Kwas siarkowy(VI): H2SO4
- Kwas siarkowy(IV) (kwas siarkawy): H2SO3
- Kwas azotowy(V): HNO3
- Kwas azotowy(III) (kwas azotawy): HNO2
- Kwas węglowy: H2CO3
- Kwas fosforowy(V) (kwas ortofosforowy): H3PO4
Praktyczne Zastosowania
Zarówno kwasy beztlenowe, jak i tlenowe mają szerokie zastosowanie w przemyśle, laboratoriach oraz w życiu codziennym. Kwas chlorowodorowy (HCl) jest używany do czyszczenia metali, produkcji chlorków oraz w procesach trawiennych w żołądku. Kwas siarkowy(VI) (H2SO4) jest jednym z najważniejszych chemikaliów przemysłowych, używanym w produkcji nawozów, detergentów, tworzyw sztucznych oraz w akumulatorach. Kwas azotowy(V) (HNO3) jest stosowany w produkcji nawozów sztucznych, materiałów wybuchowych i barwników. Zastosowania kwasów są wszechstronne i fundamentalne dla wielu gałęzi przemysłu.
Podsumowując, kwasy dzielimy na kwasy beztlenowe, które nie zawierają atomów tlenu, oraz kwasy tlenowe, które te atomy posiadają. Zrozumienie wzorów i budowy tych kwasów jest kluczowe dla zrozumienia reakcji chemicznych i ich zastosowań w różnych dziedzinach życia.