Cześć! Przygotowujesz się do testu z wzorów i nazw soli? Super! Ten przewodnik pomoże Ci usystematyzować wiedzę i poczuć się pewniej na egzaminie. Skupimy się na najważniejszych zagadnieniach, żeby nic Cię nie zaskoczyło.
Podstawy: Co to są sole?
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą, w procesie zwanym reakcją zobojętniania. Możemy też otrzymać sole na inne sposoby, na przykład przez reakcję metalu z kwasem lub tlenku kwasowego z tlenkiem zasadowym.
Zapamiętaj! Sole składają się z kationu metalu (lub kationu amonu, NH4+) oraz anionu reszty kwasowej.
Rodzaje soli
Wyróżniamy kilka podstawowych rodzajów soli:
- Sole obojętne: Powstają, gdy wszystkie atomy wodoru w kwasie zostaną zastąpione atomami metalu (lub grupą amonową). Przykład: NaCl (chlorek sodu).
- Sole kwaśne (wodorosole): Powstają, gdy nie wszystkie atomy wodoru w kwasie zostaną zastąpione atomami metalu. Zawierają w swojej strukturze atom wodoru. Przykład: NaHCO3 (wodorowęglan sodu).
- Sole zasadowe (hydroksosole): Powstają, gdy nie wszystkie grupy wodorotlenowe w zasadzie zostaną zastąpione resztą kwasową. Zawierają w swojej strukturze grupę wodorotlenową OH-. Przykład: Mg(OH)Cl (hydroksychlorek magnezu).
- Sole podwójne: Zawierają dwa różne kationy metali (lub kation amonu) połączone z jednym anionem reszty kwasowej. Przykład: KAl(SO4)2 (siarczan glinowo-potasowy).
- Sole uwodnione (hydraty): Zawierają w swojej strukturze cząsteczki wody. Przykład: CuSO4 * 5H2O (pentahydrat siarczanu(VI) miedzi(II)).
Nazewnictwo soli
Kluczem do poprawnego nazywania soli jest znajomość nazw i wzorów kwasów i metali (oraz ich wartościowości!).
Zasady tworzenia nazw soli obojętnych
Nazwę soli tworzymy w następujący sposób: nazwa reszty kwasowej + nazwa metalu + (wartościowość metalu, jeśli ma więcej niż jedną wartościowość)
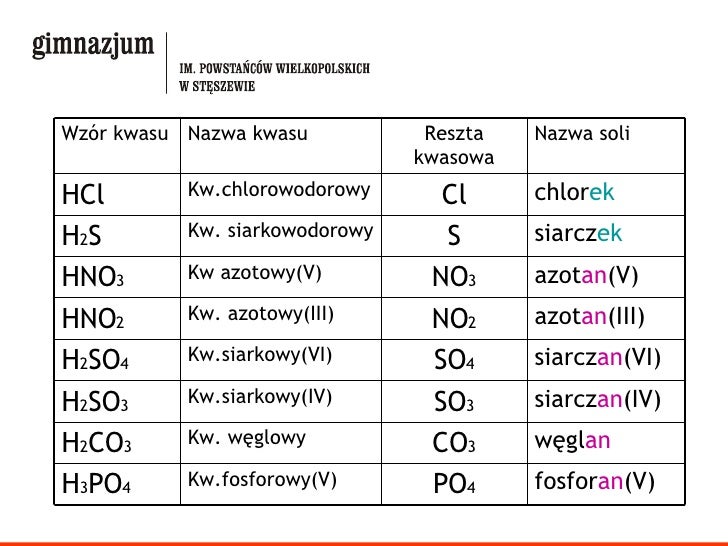
- Nazwy reszt kwasowych pochodzących od kwasów beztlenowych: dodajemy końcówkę "-ek" do nazwy niemetalu. Na przykład:
- HCl - kwas chlorowodorowy, więc reszta kwasowa Cl- to chlorek
- HBr - kwas bromowodorowy, więc reszta kwasowa Br- to bromek
- H2S - kwas siarkowodorowy, więc reszta kwasowa S2- to siarczek
- Nazwy reszt kwasowych pochodzących od kwasów tlenowych:
- Kwasy z centralnym atomem na wyższym stopniu utlenienia (np. H2SO4, HNO3, H3PO4) dają reszty kwasowe z końcówką "-an".
- Kwasy z centralnym atomem na niższym stopniu utlenienia (np. H2SO3, HNO2, H3PO3) dają reszty kwasowe z końcówką "-yn".
- H2SO4 - kwas siarkowy(VI), więc reszta kwasowa SO42- to siarczan(VI)
- H2SO3 - kwas siarkowy(IV), więc reszta kwasowa SO32- to siarczan(IV) (siarczyn)
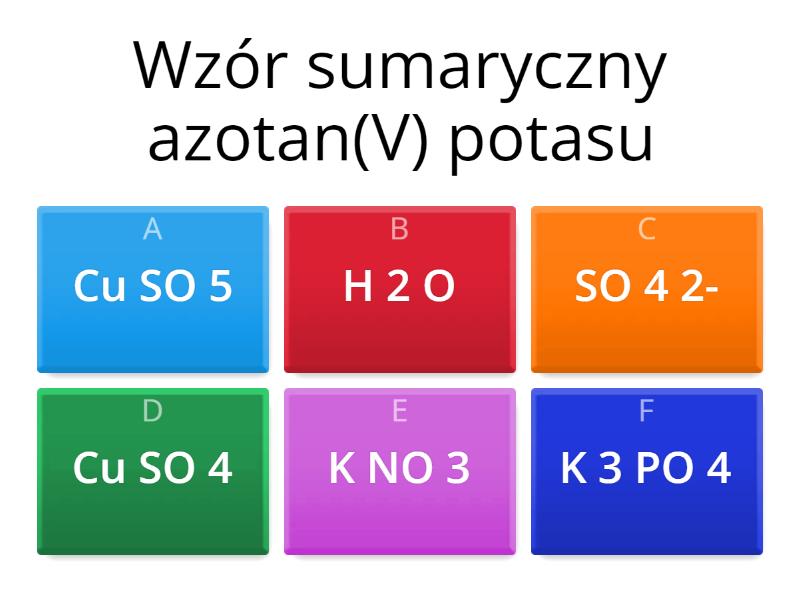
- HNO3 - kwas azotowy(V), więc reszta kwasowa NO3- to azotan(V)
- HNO2 - kwas azotowy(III), więc reszta kwasowa NO2- to azotan(III) (azotyn)
- H3PO4 - kwas fosforowy(V), więc reszta kwasowa PO43- to fosforan(V)
Przykłady nazw soli:
- NaCl - chlorek sodu
- K2SO4 - siarczan(VI) potasu
- FeCl3 - chlorek żelaza(III)
- CuSO4 - siarczan(VI) miedzi(II)
- CaCO3 - węglan wapnia
Zasady tworzenia wzorów soli
Przy tworzeniu wzorów soli musisz pamiętać o wartościowości metalu i reszty kwasowej. Suma ładunków kationów musi być równa sumie ładunków anionów, aby wzór soli był elektrycznie obojętny.
Krok po kroku:
- Zapisz symbol metalu (lub grupę amonową) i resztę kwasową.
- Określ wartościowość metalu i reszty kwasowej.
- Skrzyżuj wartościowości i zapisz je jako indeksy stechiometryczne.
- Uprość indeksy, jeśli to możliwe.
Przykład: Napisz wzór siarczanu(VI) glinu.
- Al SO4
- Al3+ SO42-
- Al2(SO4)3
Wzór siarczanu(VI) glinu to Al2(SO4)3.
Jak radzić sobie z trudnymi przypadkami?
Czasami zadania mogą być bardziej skomplikowane. Oto kilka wskazówek:
- Sole kwaśne i zasadowe: Zwróć uwagę na obecność atomów wodoru (w solach kwaśnych) lub grup wodorotlenowych (w solach zasadowych) we wzorze. W nazwie uwzględnij przedrostki "wodoro-" (dla soli kwaśnych) lub "hydrokso-" (dla soli zasadowych).
- Sole uwodnione: Zwróć uwagę na obecność kropki i liczby przed H2O we wzorze. W nazwie użyj przedrostka wskazującego na liczbę cząsteczek wody (np. penta- dla 5, heksa- dla 6, okta- dla 8) i dodaj "hydrat".
- Czytanie ze zrozumieniem: Dokładnie czytaj polecenie. Często zawiera ono cenne wskazówki dotyczące nazwy lub wzoru soli.
Przykładowe zadania
Spróbuj rozwiązać te zadania, aby sprawdzić swoją wiedzę:
- Podaj wzór chlorku wapnia.
- Nazwij związek Na2CO3.
- Napisz wzór siarczanu(IV) żelaza(II).
- Nazwij związek KHSO4.
- Napisz wzór pentahydratu siarczanu(VI) miedzi(II).
Podsumowanie
Pamiętaj o kilku kluczowych rzeczach:
- Sole składają się z kationu metalu i anionu reszty kwasowej.
- Znajomość nazw i wzorów kwasów jest niezbędna.
- Przy tworzeniu wzorów soli uwzględniaj wartościowość.
- Rozróżniaj rodzaje soli (obojętne, kwaśne, zasadowe, uwodnione).
- Ćwicz, ćwicz i jeszcze raz ćwicz! Im więcej zadań rozwiążesz, tym lepiej utrwalisz wiedzę.
Powodzenia na teście! Wierzę w Ciebie!