Hej! Przygotowujesz się do kartkówki z wzorów i nazw soli? Super! Jestem tu, żeby Ci pomóc. Zrozumienie tego tematu jest kluczowe, a razem na pewno dasz radę!
Podstawy, które musisz znać
Zacznijmy od podstaw. Co to właściwie są sole? To związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą (lub metalem).
Budowa soli
Sole składają się z kationu metalu (np. Na+, Ca2+) i anionu reszty kwasowej (np. Cl-, SO42-). Pamiętaj o tym!
Nazewnictwo soli
Nazwa soli składa się z dwóch części: nazwy anionu reszty kwasowej i nazwy kationu metalu. Na przykład, chlorek sodu (NaCl).
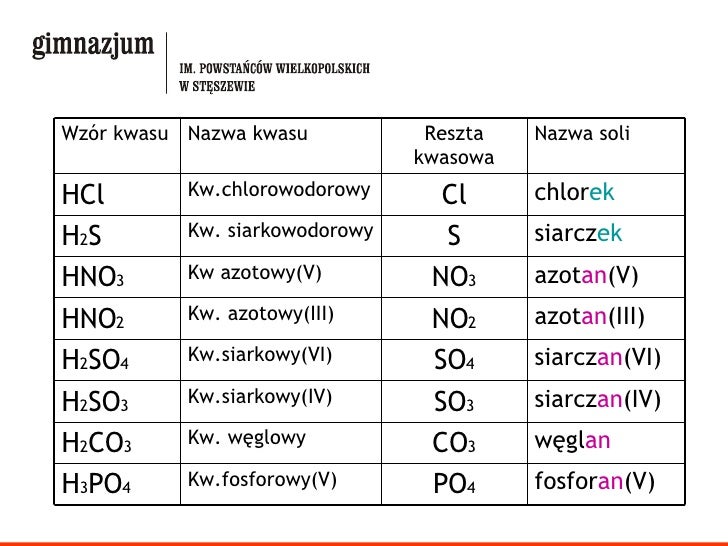
Kwasy i ich reszty kwasowe
Znajomość kwasów i ich reszt kwasowych to podstawa. Przyjrzyjmy się kilku popularnym przykładom.
Kwasy beztlenowe
Kwasy beztlenowe to takie, które nie zawierają tlenu.
Kwas chlorowodorowy (HCl) tworzy resztę kwasową chlorkową (Cl-). Sole tego kwasu nazywamy chlorkami.
Kwas siarkowodorowy (H2S) tworzy resztę kwasową siarczkową (S2-). Sole tego kwasu to siarczki.
Kwasy tlenowe
Kwasy tlenowe zawierają w swojej cząsteczce tlen. Nazewnictwo ich reszt kwasowych jest nieco bardziej złożone.
Kwas siarkowy(VI) (H2SO4) tworzy resztę kwasową siarczanową(VI) (SO42-). Sole tego kwasu to siarczany(VI).
Kwas siarkowy(IV) (H2SO3) tworzy resztę kwasową siarczanową(IV) (SO32-). Sole tego kwasu to siarczany(IV) (czasami nazywane siarczynami).
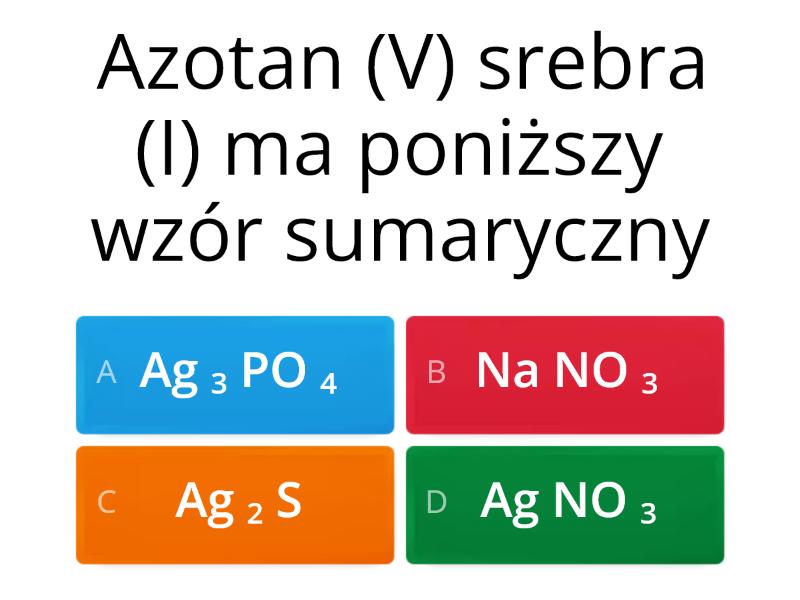
Kwas azotowy(V) (HNO3) tworzy resztę kwasową azotanową(V) (NO3-). Sole tego kwasu to azotany(V).
Kwas azotowy(III) (HNO2) tworzy resztę kwasową azotanową(III) (NO2-). Sole tego kwasu to azotany(III) (czasami nazywane azotynami).
Kwas węglowy (H2CO3) tworzy resztę kwasową węglanową (CO32-). Sole tego kwasu to węglany.
Kwas ortofosforowy(V) (H3PO4) tworzy resztę kwasową ortofosforanową(V) (PO43-). Sole tego kwasu to ortofosforany(V) (często po prostu fosforany).
Tworzenie wzorów soli
Teraz przejdźmy do tworzenia wzorów soli. Pamiętaj, że suma ładunków kationów i anionów w soli musi wynosić zero. To kluczowe!
Przykłady
Chlorek sodu (NaCl): Sód (Na+) ma ładunek +1, a chlorek (Cl-) ma ładunek -1. Suma ładunków to +1 + (-1) = 0.
Siarczan(VI) wapnia (CaSO4): Wapń (Ca2+) ma ładunek +2, a siarczan(VI) (SO42-) ma ładunek -2. Suma ładunków to +2 + (-2) = 0.
Azotan(V) glinu (Al(NO3)3): Glin (Al3+) ma ładunek +3, a azotan(V) (NO3-) ma ładunek -1. Potrzebujemy trzech jonów azotanowych(V), aby zrównoważyć ładunek glinu. Wzór to Al(NO3)3.
Fosforan(V) potasu (K3PO4): Potas (K+) ma ładunek +1, a fosforan(V) (PO43-) ma ładunek -3. Potrzebujemy trzech jonów potasu, aby zrównoważyć ładunek fosforanu(V). Wzór to K3PO4.
Krok po kroku
- Określ ładunek kationu metalu.
- Określ ładunek anionu reszty kwasowej.
- Dobierz odpowiednią liczbę kationów i anionów, aby suma ładunków wynosiła zero.
- Zapisz wzór soli.
Nazewnictwo soli – krok po kroku
Nazewnictwo soli jest równie ważne jak tworzenie wzorów. Oto jak to robić:
- Zidentyfikuj anion reszty kwasowej (np. chlorek, siarczan(VI), azotan(V)).
- Zidentyfikuj kation metalu (np. sód, wapń, glin).
- Połącz nazwy: nazwa anionu + nazwa kationu (np. chlorek sodu, siarczan(VI) wapnia, azotan(V) glinu).
Metale o zmiennej wartościowości
Jeżeli metal ma zmienną wartościowość, trzeba ją podać w nazwie soli, w nawiasie, cyframi rzymskimi. Na przykład, chlorek żelaza(II) (FeCl2) i chlorek żelaza(III) (FeCl3).
Przykładowe zadania
Sprawdźmy Twoją wiedzę na kilku przykładach:
1. Napisz wzór siarczanu(VI) glinu.
2. Podaj nazwę związku K2CO3.
3. Napisz wzór ortofosforanu(V) wapnia.
4. Podaj nazwę związku FeBr2.
Wskazówki i triki
Zapamiętaj najczęściej występujące reszty kwasowe i ich ładunki.
Zwracaj uwagę na wartościowość metali. Szczególnie tych, które mają zmienną wartościowość.
Ćwicz! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz ten temat.
Podsumowanie
Pamiętaj, sole powstają w wyniku reakcji kwasów z zasadami lub metalami.
Nazwa soli składa się z nazwy anionu reszty kwasowej i nazwy kationu metalu.
Wzór soli musi być elektrycznie obojętny – suma ładunków kationów i anionów musi wynosić zero.
Ucz się regularnie i nie bój się pytać! Powodzenia na kartkówce!