Chemia może wydawać się skomplikowana, ale zrozumienie podstawowych pojęć otwiera drzwi do fascynującego świata. Dzisiaj zajmiemy się kwasami, a konkretnie ich wzorami i nazwami. Skupimy się na wiedzy potrzebnej do kartkówki w ósmej klasie.
Co to jest kwas?
Kwas to związek chemiczny, który w roztworze wodnym uwalnia jony wodorowe (H+). Te jony nadają kwasom charakterystyczny kwaśny smak (choć absolutnie nie wolno próbować kwasów w laboratorium!), oraz zdolność reagowania z metalami i zasadami. Pomyśl o soku z cytryny – jest kwaśny właśnie dzięki zawartości kwasu cytrynowego.
Ważne jest rozróżnienie między kwasami beztlenowymi i kwasami tlenowymi. Różnią się one budową i sposobem tworzenia nazw. Zaczniemy od kwasów beztlenowych.
Kwasy Beztlenowe
Kwasy beztlenowe to związki wodoru z niemetalami. Charakterystyczne dla nich jest to, że w ich cząsteczkach nie ma atomów tlenu. Najprostszy przykład to kwas chlorowodorowy (HCl), znany także jako kwas solny.
Wzory kwasów beztlenowych
Wzór kwasu beztlenowego składa się z symbolu wodoru (H) i symbolu niemetalu. Indeks dolny przy wodorze określa, ile atomów wodoru łączy się z jednym atomem niemetalu. Liczba ta zależy od wartościowości niemetalu. Wartościowość to zdolność atomu do tworzenia wiązań chemicznych.
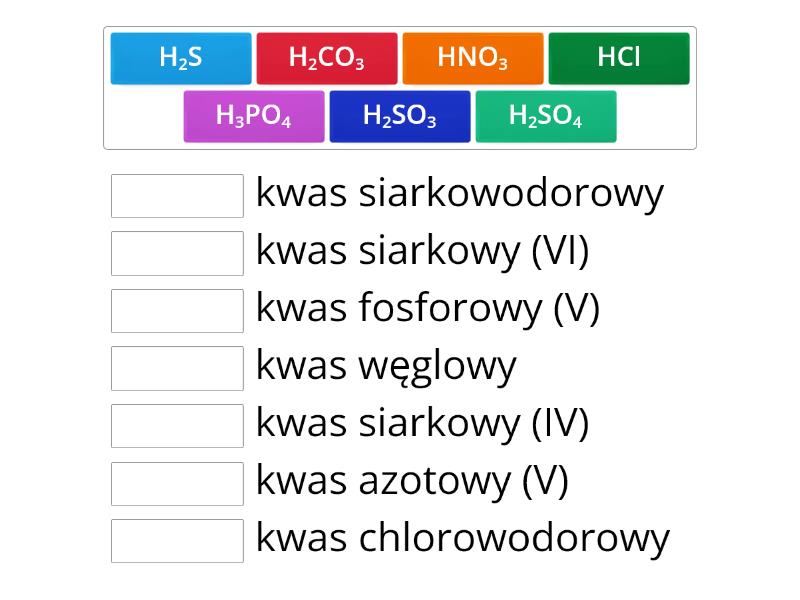
Na przykład, chlor (Cl) jest jednowartościowy, więc kwas chlorowodorowy ma wzór HCl. Siarka (S) jest dwuwartościowa, dlatego kwas siarkowodorowy ma wzór H2S. Zazwyczaj wartościowości niemetali można znaleźć w układzie okresowym pierwiastków.
Nazewnictwo kwasów beztlenowych
Nazwa kwasu beztlenowego tworzona jest przez dodanie przedrostka "kwas" oraz przyrostka "-owodorowy" do nazwy niemetalu. Na przykład:
- HCl - kwas chlorowodorowy (od chloru)
- H2S - kwas siarkowodorowy (od siarki)
- HF - kwas fluorowodorowy (od fluoru)
- HBr - kwas bromowodorowy (od bromu)
- HI - kwas jodowodorowy (od jodu)
Zapamiętaj tę zasadę! "Kwas" + nazwa niemetalu + "-owodorowy". Dzięki temu łatwo zapamiętasz i odtworzysz nazwy tych kwasów.
Kwasy Tlenowe
Kwasy tlenowe są bardziej złożone. Zawierają wodór, tlen i jeszcze jeden pierwiastek, często niemetal. Typowy przykład to kwas siarkowy (H2SO4), który jest szeroko stosowany w przemyśle.
Wzory kwasów tlenowych
Wzór kwasu tlenowego składa się z symbolu wodoru (H), symbolu pierwiastka centralnego (często niemetalu) i symbolu tlenu (O). Indeksy dolne przy każdym symbolu określają liczbę atomów danego pierwiastka w cząsteczce kwasu. Ustalanie tych indeksów wymaga zrozumienia wartościowości pierwiastków i budowy danego kwasu. Można to robić krok po kroku, zaczynając od ustalenia wartościowości pierwiastka centralnego.
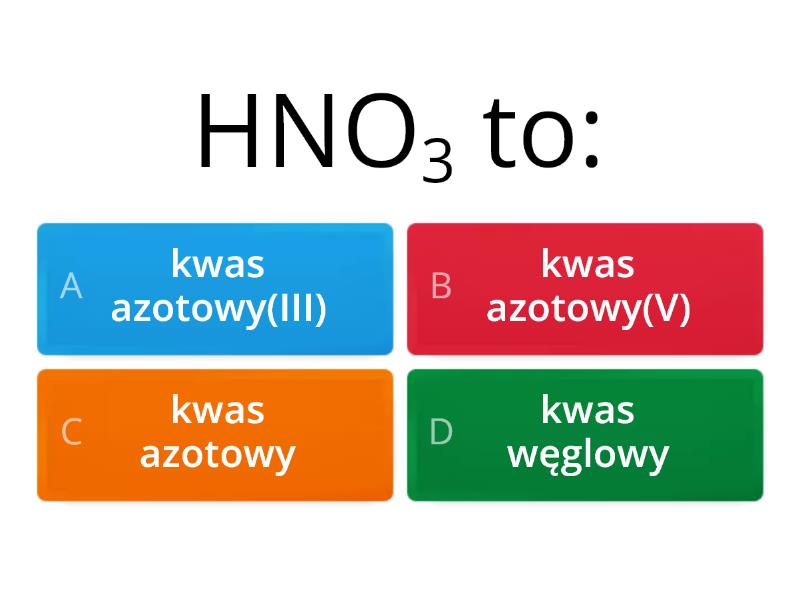
Przykładowo, w kwasie azotowym(V) (HNO3) azot (N) ma wartościowość V (5). Dwa atomy wodoru i trzy atomy tlenu równoważą tę wartościowość, tworząc stabilną cząsteczkę.
Nazewnictwo kwasów tlenowych
Nazwy kwasów tlenowych pochodzą od nazwy pierwiastka centralnego (często niemetalu) i zależą od jego stopnia utlenienia. Stopień utlenienia to liczba, która określa, ile elektronów atom stracił lub zyskał w związku z innymi atomami. Stopnie utlenienia oznaczamy cyframi rzymskimi w nawiasie po nazwie pierwiastka.
Najczęściej spotykane kwasy tlenowe i ich nazewnictwo:
- Kwasy chloru:
- HClO - kwas chlorowy(I) (inaczej: kwas podchlorawy)
- HClO2 - kwas chlorowy(III) (inaczej: kwas chlorawy)
- HClO3 - kwas chlorowy(V) (inaczej: kwas chlorowy)
- HClO4 - kwas chlorowy(VII) (inaczej: kwas nadchlorowy)
- Kwasy siarki:
- H2SO3 - kwas siarkowy(IV) (inaczej: kwas siarkawy)
- H2SO4 - kwas siarkowy(VI) (inaczej: kwas siarkowy)
- Kwasy azotu:
- HNO2 - kwas azotowy(III) (inaczej: kwas azotawy)
- HNO3 - kwas azotowy(V) (inaczej: kwas azotowy)
- Kwasy fosforu:
- H3PO4 - kwas fosforowy(V) (inaczej: kwas ortofosforowy)
- Kwasy węgla:
- H2CO3 - kwas węglowy(IV) (inaczej: kwas węglowy)
Zauważ, że jeśli pierwiastek centralny tworzy kilka kwasów tlenowych, używamy cyfr rzymskich w nazwie, aby odróżnić je od siebie. Im wyższy stopień utlenienia, tym więcej atomów tlenu w cząsteczce kwasu.
Przykłady kwasów w życiu codziennym
Kwasy otaczają nas na co dzień. Kwas octowy (CH3COOH) to główny składnik octu, który używamy w kuchni. Kwas cytrynowy (C6H8O7) znajduje się w owocach cytrusowych, takich jak cytryny i pomarańcze. Nasz żołądek produkuje kwas chlorowodorowy (HCl), który pomaga trawić pokarm. Nawet w napojach gazowanych znajdziemy kwas węglowy (H2CO3), który nadaje im charakterystyczne bąbelki.
Jak się uczyć wzorów i nazw?
Nauka wzorów i nazw kwasów wymaga systematyczności i powtarzania. Stwórz sobie listę kwasów, które musisz znać na kartkówkę. Przepisuj wzory i nazwy, starając się zapamiętać związki między nimi. Możesz też korzystać z kart edukacyjnych (flashcards), aby testować swoją wiedzę.
Pamiętaj, żeby zrozumieć zasady tworzenia nazw i wzorów, a nie tylko uczyć się ich na pamięć. Zrozumienie reguł pozwoli Ci z łatwością tworzyć nazwy i wzory kwasów, nawet jeśli nie spotkałeś ich wcześniej. Spróbuj rozwiązywać zadania, w których musisz napisać wzór kwasu na podstawie jego nazwy i odwrotnie.
Powodzenia na kartkówce! Pamiętaj, że chemia może być fascynująca, jeśli poświęcisz jej trochę czasu i uwagi. Powodzenia!