Wprowadzenie do Reszt Kwasowych
Hej! Gotowi na powtórkę z reszt kwasowych? To ważny temat, więc skupmy się na najważniejszych aspektach. Pamiętajcie, praktyka czyni mistrza! Dzisiaj zobaczymy jakie związki chemiczne zawierają reszty kwasowe.
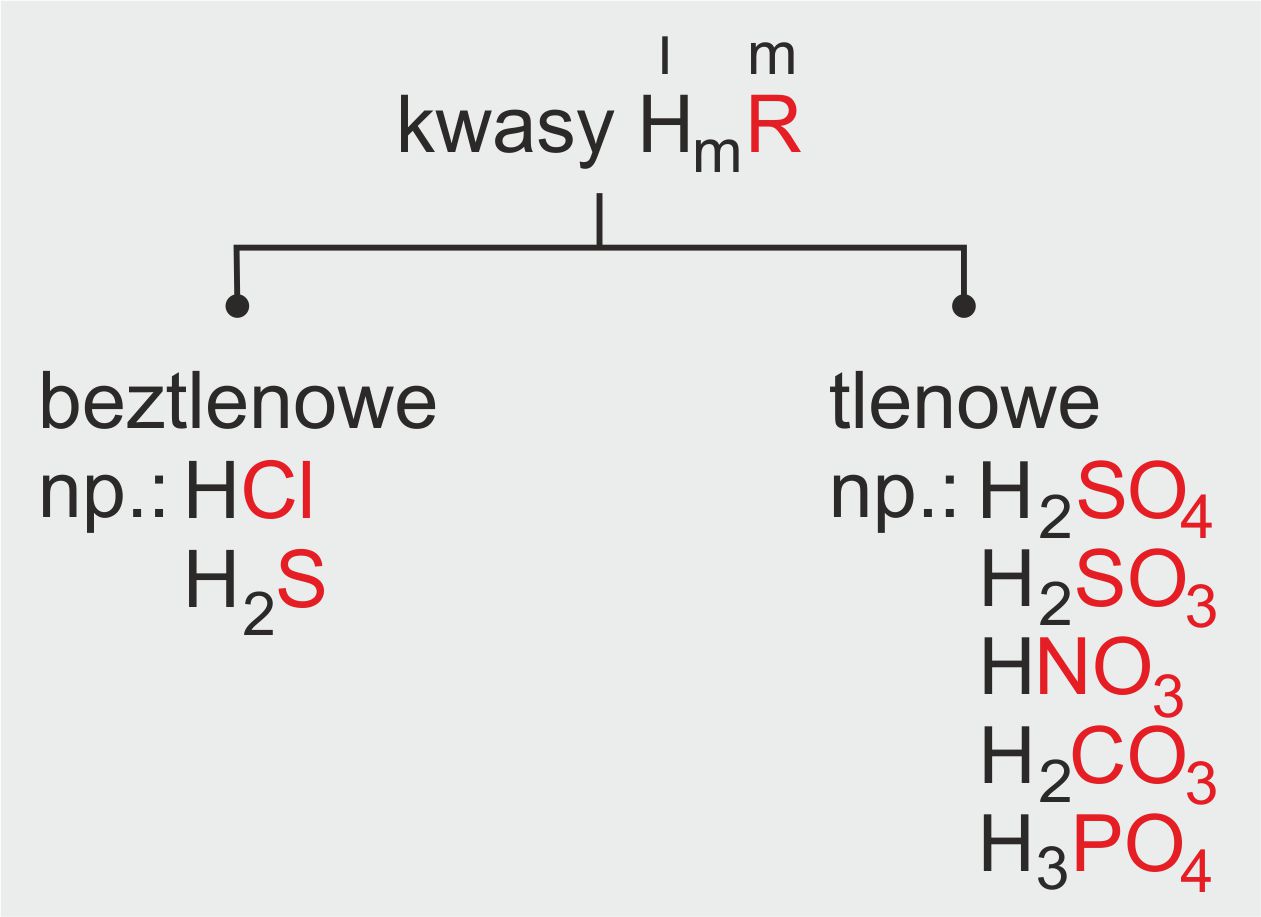
Co to są Reszty Kwasowe?
Reszta kwasowa to fragment kwasu, który powstaje po odłączeniu jednego lub więcej atomów wodoru. Inaczej mówiąc, to anion pochodzący od kwasu. Często spotkacie się z terminem anion kwasowy - to to samo! Zapamiętajcie, reszty kwasowe są naładowane ujemnie.
Gdzie Znajdziemy Reszty Kwasowe?
Reszty kwasowe występują w wielu związkach chemicznych. Przede wszystkim w solach. Ale nie tylko tam! Ważne żeby je umieć rozpoznać.
Sole – Królestwo Reszt Kwasowych
Sole to związki jonowe zbudowane z kationu (np. metalu) i anionu (reszty kwasowej). Na przykład, w chlorku sodu (NaCl), resztą kwasową jest jon chlorkowy (Cl-), pochodzący od kwasu solnego (HCl). Zwróćcie uwagę na ładunki! Wzory sumaryczne soli są zawsze elektrycznie obojętne.
Spójrzmy na siarczan(VI) potasu (K2SO4). Resztą kwasową jest tutaj jon siarczanowy(VI) (SO42-), pochodzący od kwasu siarkowego(VI) (H2SO4). Liczba atomów potasu wskazuje na wartościowość reszty kwasowej.
A co z azotanem(V) wapnia (Ca(NO3)2)? Resztą kwasową jest jon azotanowy(V) (NO3-), pochodzący od kwasu azotowego(V) (HNO3). Indeks dolny "2" przy grupie azotanowej wskazuje, że wapń ma wartościowość 2.
Wodorosole - Kolejny ważny przykład
Wodorosole to sole, w których nie wszystkie atomy wodoru w kwasie zostały zastąpione metalem. Zawierają one zarówno kation metalu, jak i jon wodorowy oraz resztę kwasową. Na przykład, w wodorowęglanie sodu (NaHCO3), mamy jon wodorowęglanowy (HCO3-), który pochodzi od kwasu węglowego (H2CO3). Pamiętajcie, wodorosole zawierają "H" w swoim wzorze!
Związki Kompleksowe - Trochę trudniejsze, ale damy radę!
Reszty kwasowe mogą występować również w związkach kompleksowych jako ligandy. Ligandy to jony lub cząsteczki, które otaczają atom centralny (zazwyczaj metal) i tworzą z nim wiązanie koordynacyjne. Przykładem może być [Cu(NH3)4]SO4 – siarczan(VI) tetraaminamiedzi(II). Tutaj SO42- to reszta kwasowa poza nawiasem kwadratowym, będąca anionem kompleksu. To już wyższy poziom, ale warto wiedzieć, że takie sytuacje też się zdarzają!
Podsumowanie
Pamiętajcie, że reszta kwasowa to anion pochodzący od kwasu. Najczęściej spotykamy je w solach, w tym w wodorosolach. Mogą również występować w związkach kompleksowych. Rozpoznawanie reszt kwasowych jest kluczowe do zrozumienia wzorów chemicznych i nazw związków. Powodzenia na egzaminie! Jesteście świetni!