Hej! Porozmawiajmy o wodorotlenkach. To temat, który często pojawia się na sprawdzianach w 8 klasie. Rozłożymy go na czynniki pierwsze. Użyjemy prostych słów i przykładów, żeby wszystko było jasne.
Czym są wodorotlenki?
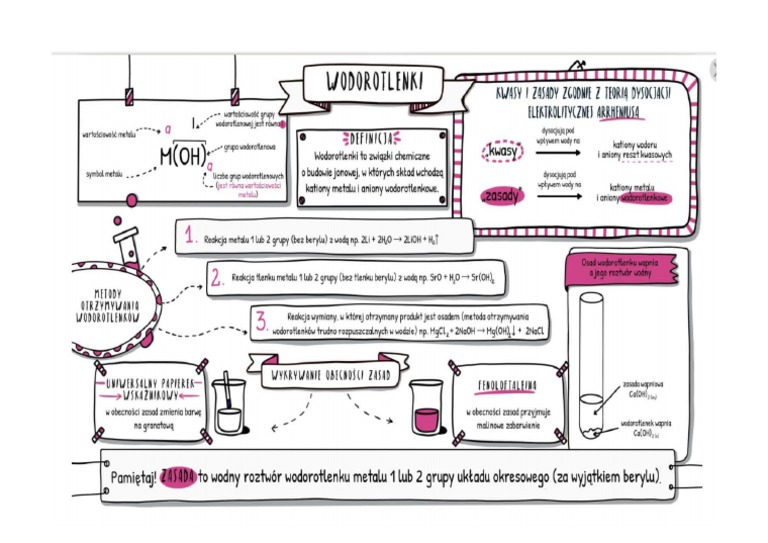
Wodorotlenki to związki chemiczne. Są one zbudowane z metalu i grupy wodorotlenowej (OH-). Ta grupa OH- to taki "znak rozpoznawczy" wodorotlenków. To właśnie ona sprawia, że wodorotlenki mają swoje charakterystyczne właściwości.
Grupa wodorotlenowa (OH-)
Grupa wodorotlenowa to atom tlenu (O) połączony z atomem wodoru (H). Ma ładunek ujemny (-1), dlatego zapisujemy ją jako OH-. To ważny element każdego wodorotlenku. Bez niej, nie byłoby wodorotlenku!
Metal
Metal to pierwiastek chemiczny. Znajdziesz go w lewej części układu okresowego. Metale mają tendencję do oddawania elektronów. Przykładami metali są sód (Na), potas (K), wapń (Ca) i magnez (Mg).
Jak powstają wodorotlenki?
Wodorotlenki powstają najczęściej w reakcji metalu z wodą. Czasem powstają też w reakcji tlenku metalu z wodą. To zależy od konkretnego metalu.
Na przykład: Sód (Na) reaguje z wodą (H2O), tworząc wodorotlenek sodu (NaOH) i wodór (H2). To dość gwałtowna reakcja. Inne metale reagują wolniej, a niektóre wcale.
Nazewnictwo wodorotlenków
Nazwa wodorotlenku składa się z dwóch części. Pierwsza to słowo "wodorotlenek". Druga to nazwa metalu, który wchodzi w skład wodorotlenku. Jeśli metal ma różną wartościowość, to podajemy ją w nawiasie cyfrą rzymską.
Przykłady: Wodorotlenek sodu (NaOH). Wodorotlenek potasu (KOH). Wodorotlenek wapnia (Ca(OH)2). Wodorotlenek żelaza(II) (Fe(OH)2) – żelazo ma wartościowość II. Wodorotlenek żelaza(III) (Fe(OH)3) – żelazo ma wartościowość III.
Właściwości wodorotlenków
Wodorotlenki mają różne właściwości. Zależą one od metalu, który wchodzi w ich skład. Generalnie, roztwory wodorotlenków mają odczyn zasadowy (alkaliczny). Oznacza to, że pH roztworu jest większe niż 7.
Wiele wodorotlenków to substancje żrące. Należy z nimi ostrożnie postępować. Mają śliski dotyk. Reagują z kwasami, tworząc sole i wodę (reakcja neutralizacji).
Przykłady wodorotlenków i ich zastosowanie
Wodorotlenek sodu (NaOH), czyli soda kaustyczna. Używany jest do produkcji mydła, papieru, a także do udrażniania rur. Jest bardzo żrący.
Wodorotlenek potasu (KOH), czyli potaż kaustyczny. Używany jest do produkcji mydeł potasowych (mydła w płynie), w akumulatorach alkalicznych. Podobnie jak NaOH, jest żrący.
Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone. Używany jest w budownictwie (zaprawa murarska), rolnictwie (do odkwaszania gleby). Jest mniej żrący niż NaOH i KOH.
Wodorotlenek magnezu (Mg(OH)2). Znajduje się w lekach zobojętniających kwas żołądkowy. Jest mniej żrący niż NaOH, KOH i Ca(OH)2.
Reakcje wodorotlenków
Wodorotlenki uczestniczą w wielu reakcjach chemicznych. Najważniejsze to reakcje z kwasami (neutralizacja). Wodorotlenki reagują z kwasami, tworząc sól i wodę.
Na przykład: NaOH + HCl → NaCl + H2O. Wodorotlenek sodu reaguje z kwasem solnym, tworząc chlorek sodu (sól kuchenną) i wodę.
Wodorotlenki mogą reagować z tlenkami niemetali. Na przykład, wodorotlenek wapnia reaguje z dwutlenkiem węgla z powietrza. Tworzy węglan wapnia (składnik wapienia).
Wskaźniki
Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Używa się ich do wykrywania, czy roztwór jest kwasowy, zasadowy, czy obojętny.
Przykłady wskaźników: Lakmus (czerwony w kwasach, niebieski w zasadach). Fenoloftaleina (bezbarwna w kwasach i obojętnym, malinowa w zasadach). Oranż metylowy (czerwony w kwasach, żółty w zasadach).
Dzięki wskaźnikom możemy łatwo sprawdzić, czy dany roztwór ma odczyn zasadowy (czy zawiera wodorotlenki).
Sprawdzian w 8 klasie
Na sprawdzianie z wodorotlenków w 8 klasie, możesz spodziewać się pytań dotyczących: definicji wodorotlenków, wzorów sumarycznych wodorotlenków, nazewnictwa wodorotlenków, właściwości wodorotlenków, reakcji wodorotlenków (zwłaszcza neutralizacji), zastosowań wodorotlenków oraz wskaźników. Warto powtórzyć te zagadnienia.
Pamiętaj o opanowaniu wzorów i nazw najważniejszych wodorotlenków. Zrozumienie reakcji chemicznych jest kluczowe. Ćwicz rozwiązywanie zadań. Powodzenia!
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć wodorotlenki. Powodzenia na sprawdzianie!