Wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową OH-, połączoną wiązaniem jonowym z kationem metalu. Najprościej mówiąc, są to zasady.
Główną cechą wodorotlenków jest ich odczyn zasadowy. Oznacza to, że roztwory wodorotlenków mają pH powyżej 7. Wodorotlenki reagują z kwasami, tworząc sole i wodę (reakcja zobojętniania).
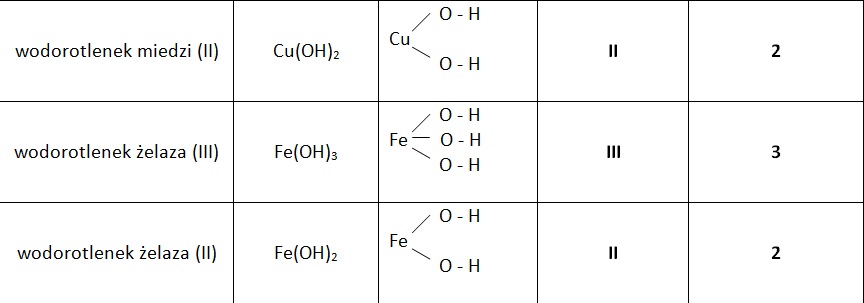
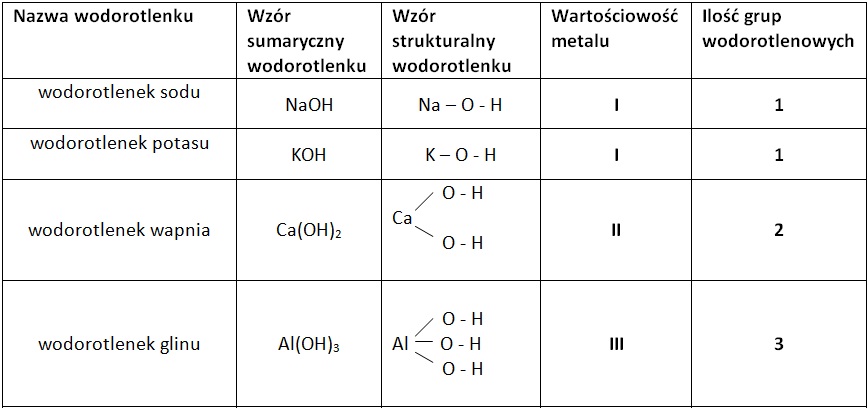
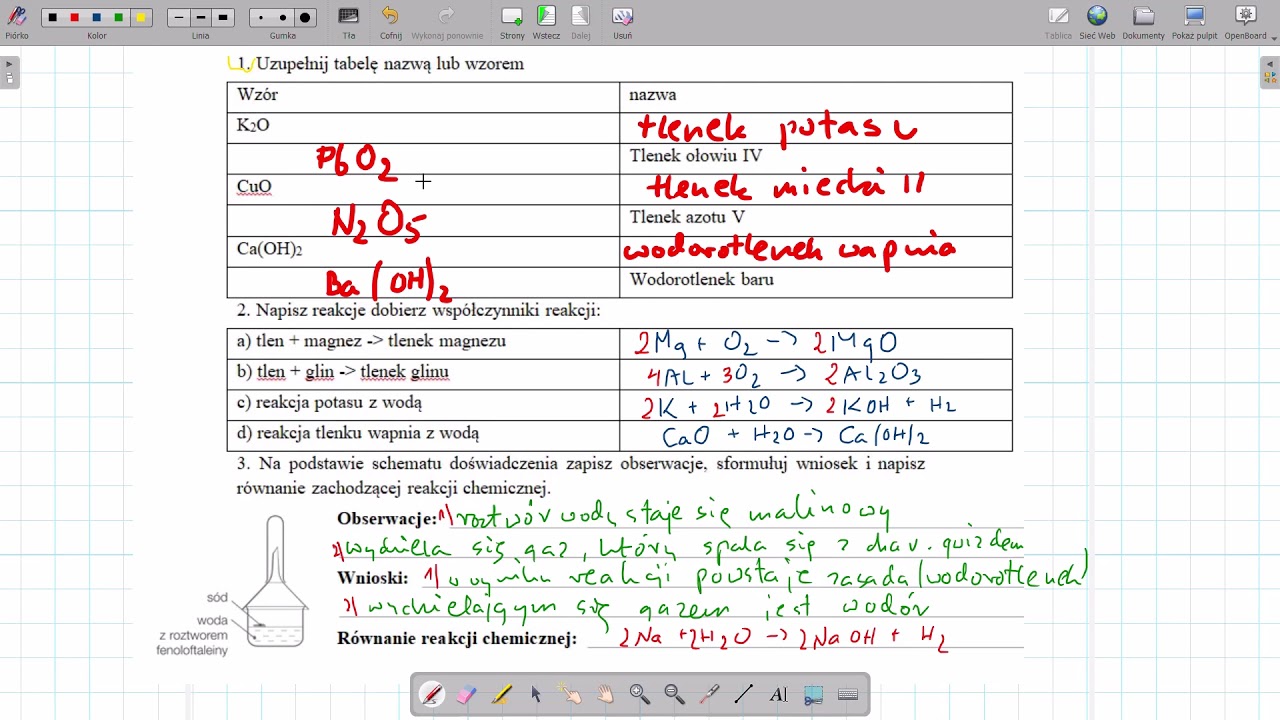
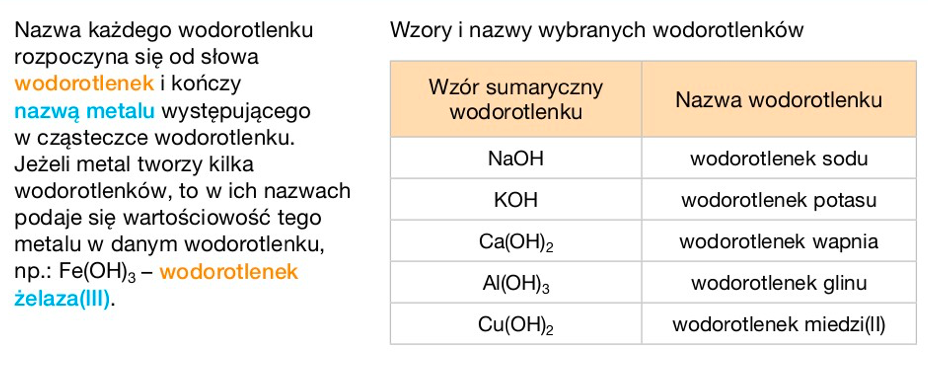
Nomenklatura wodorotlenków opiera się na nazwie metalu i dodaniu słowa "wodorotlenek". Jeżeli metal ma więcej niż jedną wartościowość, używamy rzymskiej cyfry w nawiasie, aby ją określić. Na przykład: wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH), wodorotlenek żelaza(II) (Fe(OH)2).
Otrzymywanie wodorotlenków często polega na reakcji aktywnych metali z wodą. Przykład: 2Na + 2H2O → 2NaOH + H2↑. Można je również otrzymywać przez reakcję tlenków metali z wodą: CaO + H2O → Ca(OH)2.
Właściwości fizyczne wodorotlenków zależą od metalu, z którym są połączone. Zazwyczaj są to ciała stałe o strukturze krystalicznej. Wiele wodorotlenków metali alkalicznych (np. NaOH, KOH) dobrze rozpuszcza się w wodzie, tworząc silne zasady, podczas gdy inne (np. wodorotlenki metali przejściowych) są słabo rozpuszczalne.
Przykłady:
- Wodorotlenek sodu (NaOH): silna zasada, używana w przemyśle chemicznym i produkcji mydła.
- Wodorotlenek wapnia (Ca(OH)2): znany jako wapno gaszone, używany w budownictwie i rolnictwie do odkwaszania gleby.
Wodorotlenki mają szerokie zastosowanie w przemyśle, laboratoriach i życiu codziennym. Są używane do produkcji mydeł, detergentów, papieru, leków, w procesach oczyszczania wody i ścieków oraz w wielu innych dziedzinach. Należy pamiętać o zachowaniu ostrożności podczas pracy z wodorotlenkami, ponieważ są to substancje żrące.