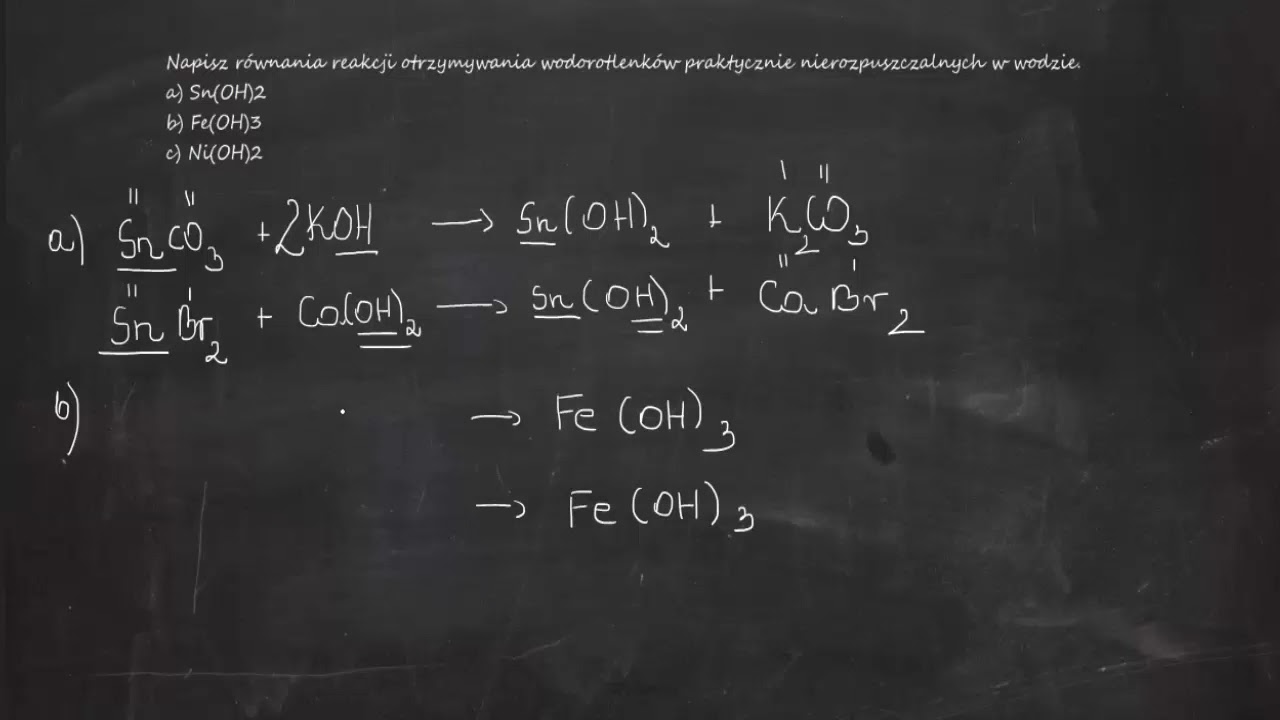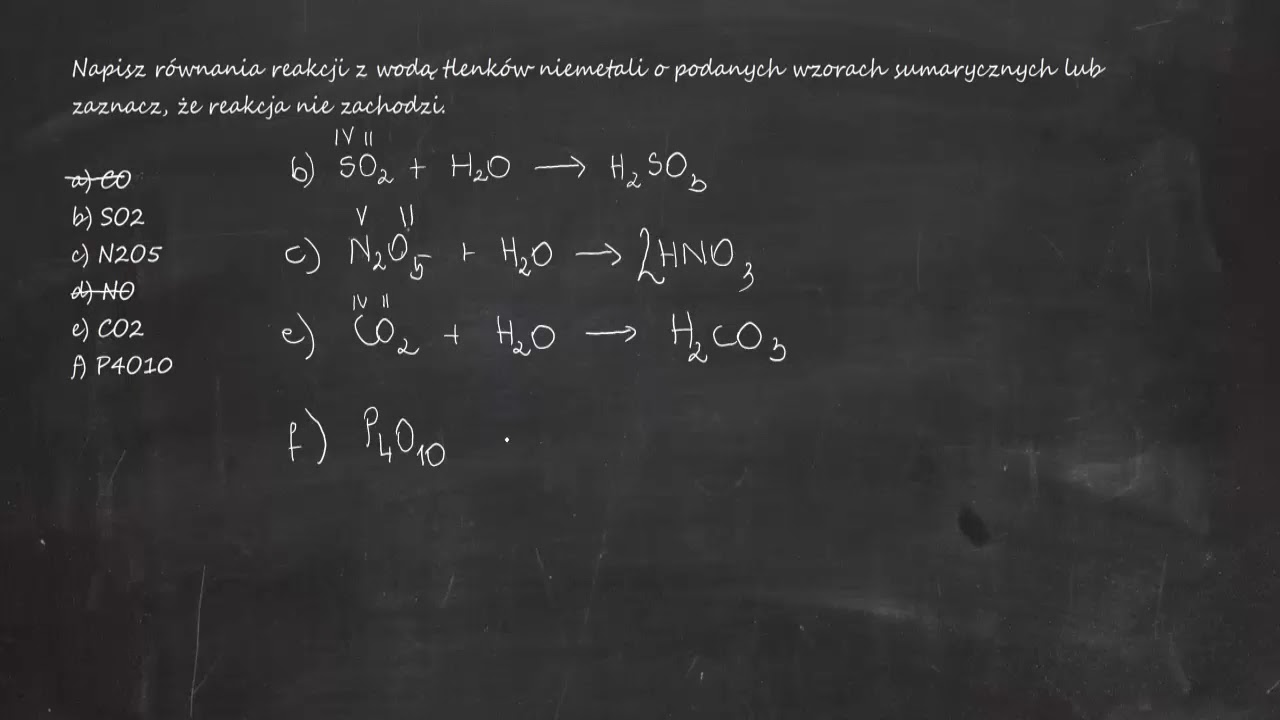Temat wodorotlenków i równań reakcji z nimi związanych jest kluczowy w chemii. Zrozumienie tych zagadnień umożliwia uczniom przewidywanie i interpretowanie wielu procesów chemicznych. Przygotujmy się, by przekazać tę wiedzę w sposób efektywny i angażujący.
Czym są Wodorotlenki?
Wodorotlenki to związki chemiczne. Zawierają one grupę hydroksylową (OH-). Grupa ta łączy się z metalem. Wodorotlenki metali alkalicznych i ziem alkalicznych to silne zasady. Inne wodorotlenki mogą mieć charakter amfoteryczny.
Warto zacząć od prostego przykładu. Pokaż, jak powstaje wodorotlenek sodu (NaOH). Zwróć uwagę na wiązanie jonowe między jonem sodu (Na+) a jonem hydroksylowym (OH-). Zwróć też uwagę na właściwości NaOH, jak np. silne zasadowe działanie.
Nazewnictwo Wodorotlenków
Nazewnictwo wodorotlenków jest proste. Składa się z dwóch członów: "wodorotlenek" i nazwa metalu. Jeśli metal tworzy kilka stopni utlenienia, dodajemy w nawiasie liczbę rzymską. Oznacza ona stopień utlenienia metalu. Na przykład: wodorotlenek żelaza(II) to Fe(OH)2.
Ćwiczcie nazewnictwo w klasie. Rozdaj karty z wzorami i poproś o podanie nazw. Możesz też zrobić odwrotnie. Dyktuj nazwy, a uczniowie niech zapisują wzory. To utrwala wiedzę.
Właściwości Wodorotlenków
Właściwości wodorotlenków zależą od metalu, z którym połączona jest grupa hydroksylowa. Wodorotlenki metali alkalicznych (np. NaOH, KOH) są silnymi zasadami, dobrze rozpuszczalnymi w wodzie. Wodorotlenki metali ziem alkalicznych (np. Ca(OH)2) są słabiej rozpuszczalne. Wodorotlenki innych metali często są nierozpuszczalne w wodzie i mają charakter amfoteryczny (np. Al(OH)3, Zn(OH)2).
Przeprowadź proste eksperymenty. Pokaz, jak wodorotlenki reagują z kwasami (reakcja neutralizacji). Zwróć uwagę na zmianę pH roztworu. Możesz użyć wskaźników pH, takich jak papierek uniwersalny lub fenoloftaleina. Obserwacja zmian koloru jest bardzo angażująca.
Równania Reakcji z Wodorotlenkami
Równania reakcji chemicznych z udziałem wodorotlenków pokazują, jak te związki reagują z innymi substancjami. Szczególnie ważne są reakcje neutralizacji z kwasami. Inne ważne reakcje to reakcje wodorotlenków z solami.
Kluczowe jest bilansowanie równań reakcji. Upewnij się, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania. Zaczynaj od bilansowania atomów metali, potem grup hydroksylowych, a na końcu atomów wodoru i tlenu. Pokaż kilka przykładów krok po kroku.
Reakcja Neutralizacji
Reakcja neutralizacji to reakcja między kwasem a zasadą (wodorotlenkiem). W wyniku tej reakcji powstaje sól i woda. Przykład: HCl + NaOH → NaCl + H2O. Reakcja ta jest egzotermiczna, czyli wydziela ciepło.
Użyj wizualizacji. Możesz narysować na tablicy schemat reakcji neutralizacji. Pokaż, jak jony H+ z kwasu łączą się z jonami OH- z wodorotlenku, tworząc wodę. To pomaga uczniom zrozumieć mechanizm reakcji.
Reakcja Wodorotlenków z Solami
Wodorotlenki mogą reagować z solami. Reakcja zachodzi, jeśli powstaje osad. Przykład: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl. Osad wodorotlenku miedzi(II) ma niebieski kolor.
Zaplanuj demonstrację. Przeprowadź reakcję wodorotlenku z solą. Obserwacja tworzącego się osadu jest bardzo efektowna. Wyjaśnij, dlaczego reakcja zaszła (powstanie osadu).
Typowe Błędy i Jak Je Unikać
Uczniowie często mylą wzory wodorotlenków. Zapominają o uwzględnieniu wartościowości metalu. Inny błąd to nieprawidłowe bilansowanie równań reakcji. Myślą, że wszystkie wodorotlenki są dobrze rozpuszczalne w wodzie.
Stale powtarzaj podstawowe zasady. Kładź nacisk na prawidłowe pisanie wzorów chemicznych. Ćwicz bilansowanie równań reakcji. Używaj różnych przykładów i ćwiczeń. Podkreślaj różnice we właściwościach różnych wodorotlenków.
Jak Uatrakcyjnić Naukę o Wodorotlenkach?
Wykorzystuj eksperymenty i demonstracje. Są one bardzo angażujące. Używaj wizualizacji, takich jak schematy i modele. Stwórz quizy i gry edukacyjne. Wykorzystaj zasoby online, takie jak filmy i animacje. To pomaga uczniom lepiej zrozumieć i zapamiętać materiał.
Zadawaj pytania problemowe. Na przykład: "Jakie wodorotlenki można znaleźć w produktach codziennego użytku?" Zachęcaj uczniów do poszukiwania informacji. To rozwija umiejętność krytycznego myślenia.
Podsumowanie
Nauczanie o wodorotlenkach i równaniach reakcji wymaga systematycznego podejścia. Kluczowe jest jasne wyjaśnienie podstawowych pojęć. Ważne jest też unikanie typowych błędów. Używaj atrakcyjnych metod nauczania. To pomoże uczniom zrozumieć i zapamiętać ten ważny materiał.