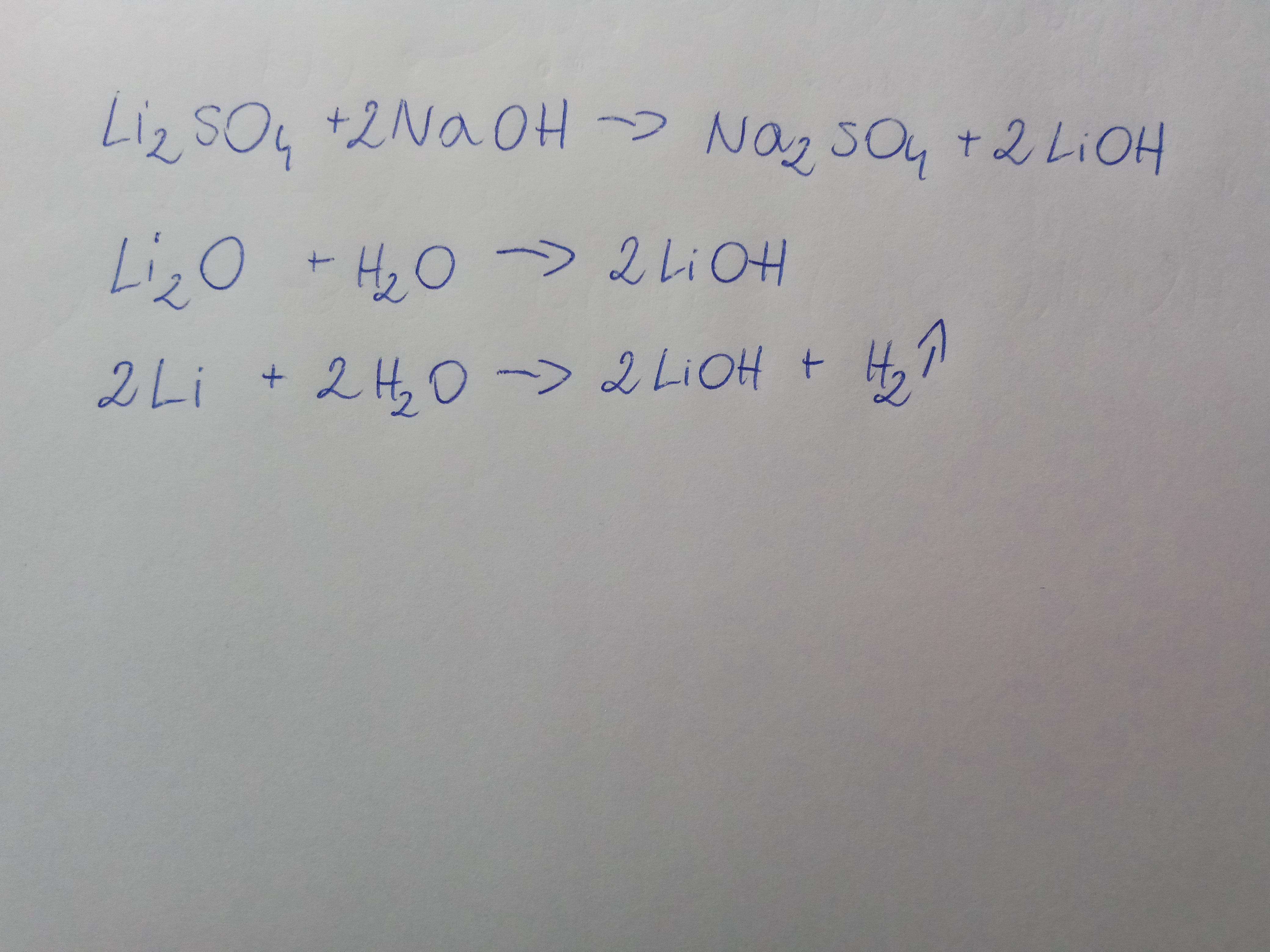Witajcie, drodzy nauczyciele chemii! Dziś zajmiemy się otrzymywaniem wodorotlenku litu. Jest to ważny związek, który pojawia się w wielu aspektach chemii, od reakcji po zastosowania praktyczne. Przygotujcie się na porcję wiedzy, która pomoże Wam w przekazaniu tego tematu Waszym uczniom.
Metody Otrzymywania Wodorotlenku Litu
Istnieje kilka sposobów na uzyskanie LiOH. Omówimy te najpopularniejsze i najbardziej przystępne do wytłumaczenia na lekcji. Ważne jest, aby zaprezentować uczniom różne podejścia do tego samego problemu, aby rozwinąć ich umiejętność logicznego myślenia.
Reakcja Litu z Wodą
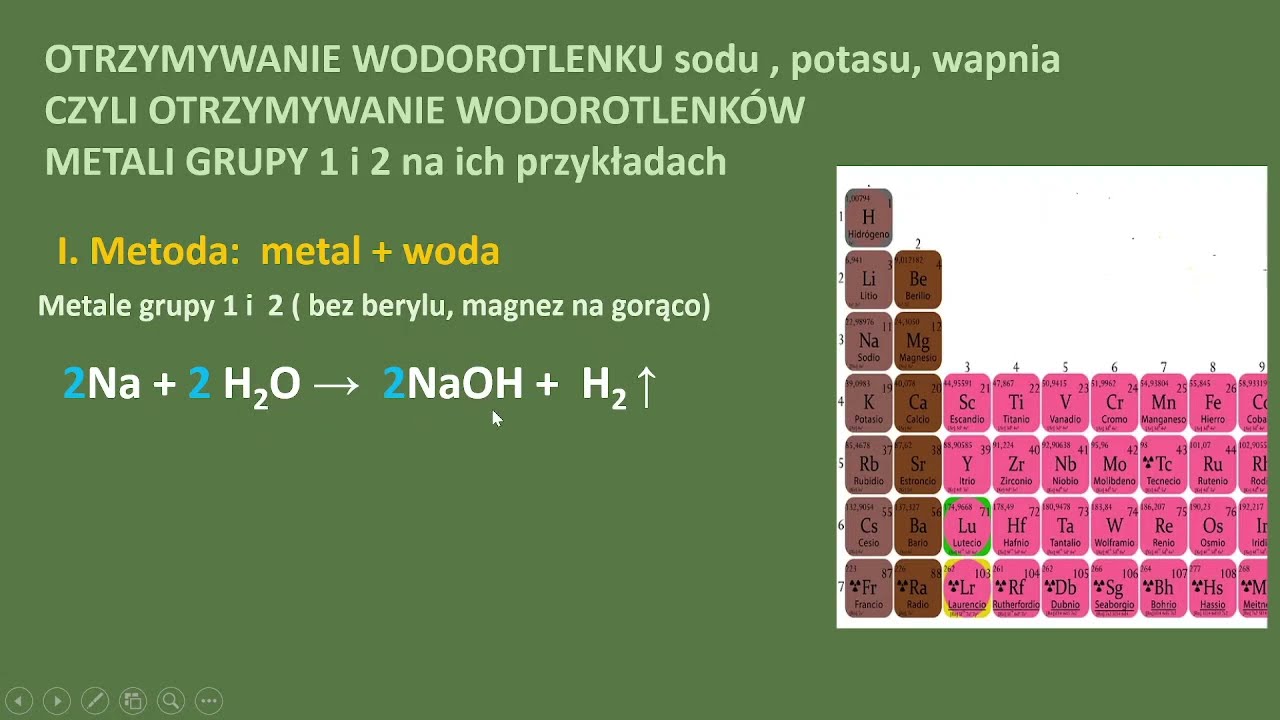
Najprostszą metodą jest reakcja litu metalicznego z wodą. Jest to reakcja egzotermiczna, co oznacza, że wydziela ciepło. Równanie reakcji wygląda następująco: 2Li(s) + 2H₂O(l) → 2LiOH(aq) + H₂(g). Pamiętajcie, żeby podkreślić, że lit reaguje z wodą mniej gwałtownie niż sód czy potas. Bezpieczeństwo jest najważniejsze przy omawianiu tego typu reakcji!
Podkreślcie, że produktami są wodorotlenek litu i wodór. Uczniowie powinni być świadomi, że wodór jest gazem palnym. Możecie pokazać filmik z takiej reakcji, aby zilustrować przebieg procesu, ale nigdy nie przeprowadzajcie tej reakcji bez odpowiedniego zabezpieczenia i doświadczenia.
Reakcja Tlenku Litu z Wodą
Inną metodą jest reakcja tlenku litu (Li₂O) z wodą. Tlenek litu jest ciałem stałym, które reaguje z wodą tworząc wodorotlenek litu. Równanie reakcji to: Li₂O(s) + H₂O(l) → 2LiOH(aq). Ta metoda jest często używana w przemyśle ze względu na stosunkowo łatwą dostępność tlenku litu.
Zwróćcie uwagę uczniów na bilansowanie równań reakcji. To doskonała okazja do powtórzenia podstawowych zasad stechiometrii. Pokażcie, jak atomy litu, tlenu i wodoru zachowują się podczas transformacji chemicznych. To utrwali ich wiedzę na temat zachowania masy.
Elektroliza Roztworu Soli Litu
Elektroliza roztworu soli litu, np. chlorku litu (LiCl), również prowadzi do powstania wodorotlenku litu. Proces ten jest bardziej złożony, ale warto go omówić na wyższych poziomach nauczania. Na katodzie zachodzi redukcja wody, a na anodzie utlenianie jonów chlorkowych. W rezultacie powstaje wodorotlenek litu, chlor i wodór.
Wyjaśnijcie rolę elektrod (anody i katody) i przepływ elektronów w obwodzie. Upewnijcie się, że uczniowie rozumieją różnicę między redukcją i utlenianiem. Elektroliza jest doskonałym przykładem reakcji redoks, które są kluczowe w chemii.
Jak Uczyć o Otrzymywaniu Wodorotlenku Litu?
Oto kilka wskazówek, które pomogą Wam w efektywnym nauczaniu o otrzymywaniu wodorotlenku litu:
* Wizualizacje: Użyjcie schematów, animacji lub filmów, aby pokazać reakcje w sposób dynamiczny. To ułatwi uczniom zrozumienie, co się dzieje na poziomie molekularnym. * Przykłady z życia codziennego: Wspomnijcie o zastosowaniach wodorotlenku litu, np. w bateriach litowo-jonowych. To pokaże uczniom, że chemia nie jest tylko teorią, ale ma praktyczne zastosowanie. * Doświadczenia (bezpieczne!): Jeśli to możliwe, przeprowadźcie proste, bezpieczne doświadczenia, np. reakcję litu z wodą w mikroskali (pod ścisłym nadzorem!). Pamiętajcie, BEZPIECZEŃSTWO przede wszystkim. * Pytania i dyskusje: Zachęcajcie uczniów do zadawania pytań i dyskusji. To pomoże im zrozumieć materiał i wyeliminować ewentualne niejasności. * Zadania i ćwiczenia: Zadawajcie zadania obliczeniowe i ćwiczenia z bilansowania równań reakcji. To utrwali ich wiedzę i umiejętności.Typowe Błędy i Nieporozumienia
Uczniowie często mylą reaktywność litu z reaktywnością sodu lub potasu. Podkreślcie, że lit reaguje z wodą mniej gwałtownie. Innym częstym błędem jest niezrozumienie roli wody w reakcji. Wyjaśnijcie, że woda nie jest tylko rozpuszczalnikiem, ale również reaguje z litem. Czasami uczniowie zapominają o bilansowaniu równań reakcji, co prowadzi do błędnych wniosków.
Niektórzy uczniowie mogą mieć trudności z rozróżnieniem między tlenkiem litu a wodorotlenkiem litu. Wyjaśnijcie, że tlenek litu zawiera tylko lit i tlen, a wodorotlenek litu zawiera lit, tlen i wodór (grupę hydroksylową OH). Zwróćcie uwagę, że wodorotlenek litu jest związkiem jonowym. Należy poświęcić czas na wytłumaczenie tych różnic.
Kolejnym potencjalnym błędem jest niezrozumienie procesu elektrolizy. Upewnijcie się, że uczniowie rozumieją, co dzieje się na każdej elektrodzie i jak powstają produkty elektrolizy. Pokażcie schemat procesu i omówcie go krok po kroku. Pomocne mogą być animacje przedstawiające ruch jonów i elektronów.
Jak Uatrakcyjnić Lekcję?
Aby uatrakcyjnić lekcję o otrzymywaniu wodorotlenku litu, możecie wykorzystać następujące metody:
* Quizy interaktywne: Użyjcie platform online do tworzenia quizów, które angażują uczniów i sprawdzają ich wiedzę w czasie rzeczywistym. * Gry edukacyjne: Stwórzcie grę, w której uczniowie będą "otrzymywać" wodorotlenek litu poprzez poprawne rozwiązywanie zadań i bilansowanie równań. * Studia przypadków: Omówcie przypadki użycia wodorotlenku litu w przemyśle, np. w produkcji baterii litowo-jonowych. To pokaże uczniom praktyczne zastosowanie omawianej wiedzy. * Praca w grupach: Podzielcie uczniów na grupy i poproście ich o przygotowanie prezentacji na temat różnych metod otrzymywania wodorotlenku litu. * Wykorzystanie technologii: Użyjcie symulacji komputerowych, które pokazują reakcje chemiczne na poziomie molekularnym.Pamiętajcie, że kluczem do skutecznego nauczania jest zaangażowanie uczniów i pokazanie im, że chemia jest fascynującą i ważną dziedziną nauki. Użyjcie swojej kreatywności i dostosujcie metody nauczania do potrzeb i zainteresowań Waszych uczniów. Powodzenia!