Woda i roztwory wodne są fundamentem życia. Wiele reakcji chemicznych zachodzi właśnie w środowisku wodnym. Zrozumienie ich właściwości jest kluczowe w nauce.
Woda: Niezwykła Substancja
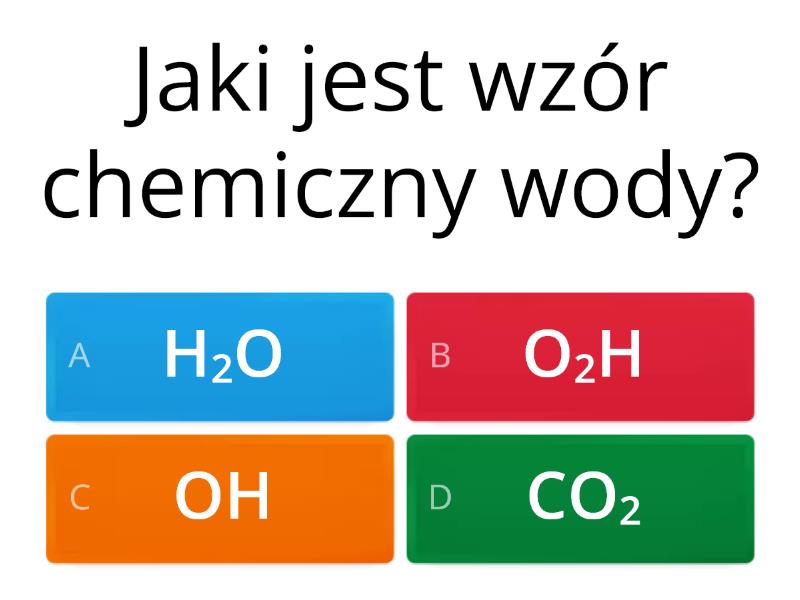
Woda (H2O) to związek chemiczny. Składa się z dwóch atomów wodoru i jednego atomu tlenu. Jej unikalna struktura nadaje jej niezwykłe właściwości.
Cząsteczka wody jest polarna. To oznacza, że ma obszar o ładunku dodatnim i obszar o ładunku ujemnym. Tlen przyciąga elektrony silniej niż wodór, tworząc dipol.
Dzięki polarności, cząsteczki wody tworzą wiązania wodorowe. Te wiązania utrzymują cząsteczki blisko siebie. Powodują wysokie napięcie powierzchniowe i dużą pojemność cieplną.
Właściwości Wody
Woda ma wysokie ciepło właściwe. Oznacza to, że potrzeba dużo energii, aby zmienić jej temperaturę. Dzięki temu oceany regulują temperaturę Ziemi.
Posiada również wysokie ciepło parowania. Dużo energii jest potrzebne do zmiany stanu skupienia z ciekłego na gazowy. To sprawia, że pocenie się chłodzi nasze ciało.
Woda jest doskonałym rozpuszczalnikiem dla wielu substancji. Szczególnie dobrze rozpuszcza związki jonowe i polarne. To dlatego nazywana jest "uniwersalnym rozpuszczalnikiem".
Roztwory Wodne: Mieszaniny Homogeniczne
Roztwór to mieszanina jednorodna. Składa się z rozpuszczalnika i substancji rozpuszczonej. W roztworach wodnych, woda jest rozpuszczalnikiem.
Substancja rozpuszczona to ta, która ulega rozproszeniu w rozpuszczalniku. Może to być ciało stałe, ciecz lub gaz. Przykładem jest sól kuchenna (NaCl) rozpuszczona w wodzie.
Rozpuszczalność to zdolność substancji do rozpuszczania się w rozpuszczalniku. Zależy od wielu czynników, takich jak temperatura i ciśnienie. Dla większości ciał stałych, rozpuszczalność rośnie wraz z temperaturą.
Rodzaje Roztworów
Możemy wyróżnić różne rodzaje roztworów. Ze względu na stopień nasycenia, dzielimy je na nienasycone, nasycone i przesycone.
Roztwór nienasycony to taki, w którym można jeszcze rozpuścić więcej substancji. Roztwór nasycony zawiera maksymalną ilość substancji, jaką można rozpuścić w danej temperaturze.
Roztwór przesycony zawiera więcej substancji niż wynikałoby to z rozpuszczalności. Jest to stan nietrwały i łatwo wytrącić nadmiar substancji w postaci kryształów.
Stężenie Roztworów
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości roztworu lub rozpuszczalnika. Istnieją różne sposoby wyrażania stężenia.
Stężenie procentowe określa masę substancji rozpuszczonej w 100 gramach roztworu. Na przykład, 10% roztwór soli zawiera 10 gramów soli w 100 gramach roztworu.
Stężenie molowe określa liczbę moli substancji rozpuszczonej w 1 litrze roztworu. Jednostką jest mol/dm3 lub M. Jest to bardzo przydatne w obliczeniach stechiometrycznych.
Obliczanie Stężeń
Aby obliczyć stężenie procentowe, używamy wzoru: stężenie procentowe = (masa substancji / masa roztworu) * 100%. Trzeba pamiętać o właściwych jednostkach.
Do obliczenia stężenia molowego potrzebna jest masa molowa substancji. Wzór to: stężenie molowe = liczba moli substancji / objętość roztworu (w dm3).
Przykład: Aby przygotować 0.1 M roztwór NaCl, potrzebujemy znać masę molową NaCl (58.44 g/mol). Następnie obliczamy, ile gramów NaCl potrzebujemy rozpuścić w 1 litrze wody.
Zastosowania Roztworów Wodnych
Roztwory wodne mają szerokie zastosowanie w życiu codziennym i w przemyśle. Są niezbędne w biologii, chemii, medycynie i wielu innych dziedzinach.
W medycynie, roztwory wodne soli fizjologicznej są używane do nawadniania organizmu. Leki często podawane są w postaci roztworów wodnych.
W przemyśle spożywczym, roztwory wodne cukru i soli są wykorzystywane w procesach konserwacji i przetwarzania żywności.
W laboratoriach, roztwory wodne są podstawowym narzędziem pracy. Wykorzystywane są do przeprowadzania reakcji chemicznych i analiz.
Podsumowanie
Woda jest kluczową substancją dla życia. Jej unikalne właściwości wynikają z polarnej budowy cząsteczki i wiązań wodorowych. Roztwory wodne to mieszaniny jednorodne, w których woda pełni rolę rozpuszczalnika. Zrozumienie właściwości wody i roztworów wodnych jest niezbędne w wielu dziedzinach nauki i życia codziennego.