Witaj! Gotowy na sprawdzian z wody i roztworów wodnych? Rozłóżmy to razem krok po kroku. Będzie łatwiej niż myślisz! Pomyśl o tym jak o gotowaniu – tylko zamiast składników na obiad, mamy cząsteczki!
Woda - Niezwykła Substancja
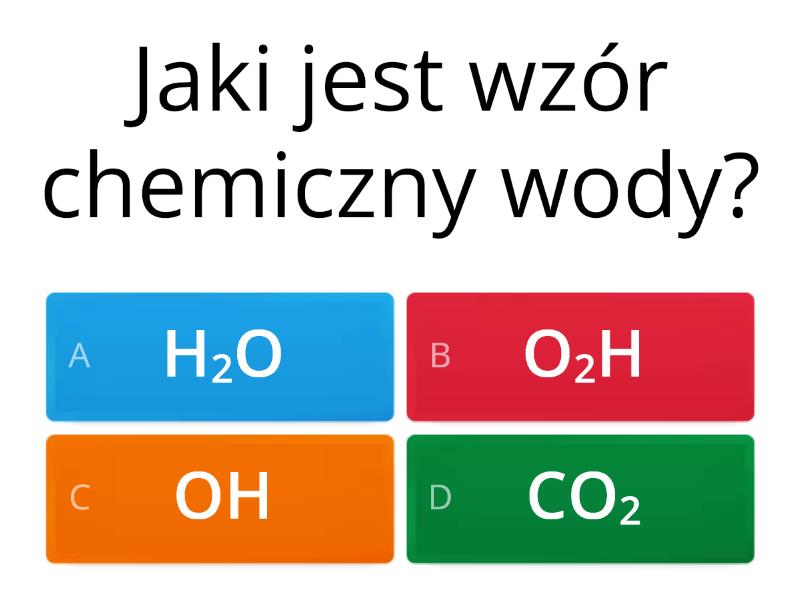
Woda (H2O) to podstawa życia. Pomyśl o sobie – w dużej mierze składasz się właśnie z niej!
Wyobraź sobie małą kropelkę wody. To mnóstwo maleńkich cząsteczek wody, trzymających się razem. Jak magnesy! To dzięki wiązaniom wodorowym.
Woda występuje w trzech stanach skupienia: stałym (lód), ciekłym (woda) i gazowym (para wodna).
Pomyśl o kostce lodu wyjętej z zamrażarki. Potem zostaw ją na stole – zamieni się w wodę. A gdy woda się zagotuje, zobaczymy parę.
Rozpuszczalność
Woda jest świetnym rozpuszczalnikiem. To znaczy, że wiele substancji może się w niej rozpuścić.
Wyobraź sobie cukier wsypywany do herbaty. Cukier znika, prawda? Ale on tam jest! Tylko rozproszył się między cząsteczkami wody. Powstał roztwór.
Nie wszystko jednak rozpuszcza się w wodzie. Olej na przykład. Dlaczego? Bo cząsteczki wody i oleju są "inne" – nie lubią się ze sobą.
Roztwory Wodne
Roztwór wodny to mieszanina wody i substancji w niej rozpuszczonej.
Pomyśl o herbacie z cukrem. Woda to rozpuszczalnik, cukier to substancja rozpuszczona, a herbata z cukrem to roztwór.
Mówimy o roztworach nienasyconych, nasyconych i przesyconych.
Wyobraź sobie szklankę wody. Wsypujesz łyżeczkę cukru – rozpuszcza się. Wsypujesz drugą – też. Ale w pewnym momencie cukier przestanie się rozpuszczać i osiądzie na dnie. To roztwór nasycony. Dodałeś tyle cukru, ile woda może maksymalnie rozpuścić w danej temperaturze.
Jeśli podgrzejesz wodę, rozpuści się więcej cukru! A jeśli potem ostrożnie ostudzisz roztwór, może się okazać, że rozpuściło się więcej cukru, niż normalnie – to roztwór przesycony. Jest bardzo niestabilny.
A roztwór nienasycony? To taki, w którym możesz jeszcze dodać substancji i ona się rozpuści.
Stężenie Procentowe
Stężenie procentowe (Cp) mówi nam, ile gramów substancji rozpuszczono w 100 gramach roztworu.
Wyobraź sobie, że masz 100 gramów roztworu soli kuchennej. Jeśli w tym roztworze jest 10 gramów soli, to stężenie procentowe wynosi 10%. Czyli Cp = 10%.
Wzór na stężenie procentowe: Cp = (ms / mr) * 100%, gdzie:
- Cp to stężenie procentowe,
- ms to masa substancji rozpuszczonej,
- mr to masa roztworu.
Pamiętaj! Masa roztworu (mr) to masa rozpuszczalnika (zazwyczaj wody) plus masa substancji rozpuszczonej (ms). Czyli mr = mw + ms.
Obliczenia Stężeń
Spróbujmy obliczyć stężenie procentowe roztworu.
Przykład: Rozpuszczono 20g soli w 80g wody. Oblicz stężenie procentowe roztworu.
1. Obliczamy masę roztworu: mr = 80g + 20g = 100g.
2. Podstawiamy do wzoru: Cp = (20g / 100g) * 100% = 20%.
Odpowiedź: Stężenie procentowe roztworu wynosi 20%.
Pamiętaj! Uważaj na jednostki! Gramy muszą być gramami!
Mieszaniny
Mieszanina to połączenie dwóch lub więcej substancji, które nie reagują ze sobą chemicznie.
Mamy mieszaniny jednorodne i mieszaniny niejednorodne.
Wyobraź sobie szklankę wody z cukrem. Cukier rozpuścił się całkowicie i nie widzisz go już jako oddzielnych kryształków. To mieszanina jednorodna.
A teraz wyobraź sobie szklankę wody z piaskiem. Piasek opadnie na dno i widzisz go jako oddzielną substancję. To mieszanina niejednorodna.
Metody Rozdzielania Mieszanin
Mieszaniny można rozdzielić na poszczególne składniki. Istnieje wiele metod.
Sączenie (filtracja): Używamy do rozdzielania mieszanin niejednorodnych, np. woda z piaskiem. Piasek zostaje na filtrze, a woda przepływa.
Odparowanie: Używamy do rozdzielania roztworów, np. sól z wody. Podgrzewamy roztwór, woda odparowuje, a sól zostaje na dnie naczynia.
Dekantacja: Zlewanie cieczy znad osadu. Na przykład, po wymieszaniu wody z piaskiem i odczekaniu, aż piasek opadnie na dno, ostrożnie zlewamy wodę.
Destylacja: Używamy do rozdzielania cieczy o różnych temperaturach wrzenia. Na przykład, do rozdzielenia wody i alkoholu.
Podsumowanie
Pamiętaj! Woda to niezwykły rozpuszczalnik. Roztwór to mieszanina wody i substancji rozpuszczonej. Stężenie procentowe mówi nam, ile substancji jest w roztworze. A mieszaniny możemy rozdzielać różnymi metodami.
Teraz już wiesz wszystko, co potrzebne, żeby poradzić sobie ze sprawdzianem! Powodzenia!