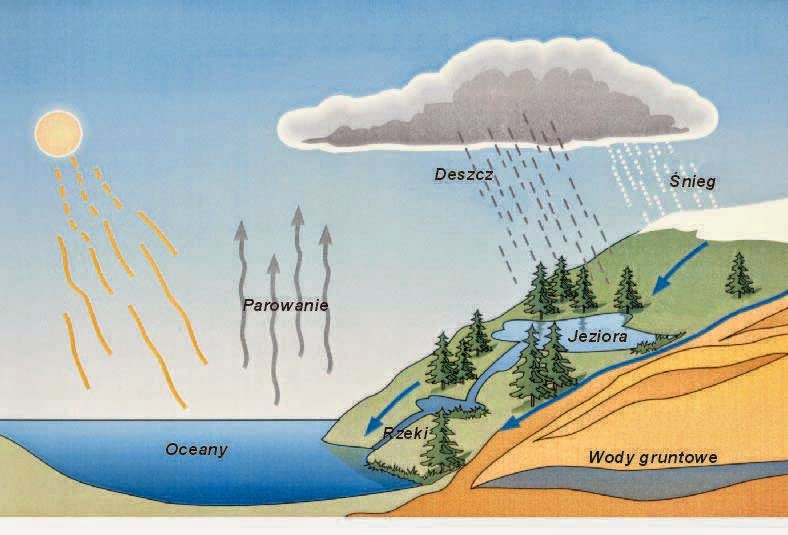
Woda jest wszechobecna. Występuje w rzekach, oceanach i chmurach. Para wodna, choć niewidoczna, unosi się w powietrzu.
Zarówno woda, jak i para wodna, są w istocie tą samą substancją. Różnica polega jedynie na ich stanie skupienia. Zrozumienie ich budowy chemicznej jest kluczowe.
Podstawy Chemii: Cząsteczki i Atomy
Aby zrozumieć, z czego zbudowana jest woda i para wodna, musimy najpierw przypomnieć sobie podstawowe pojęcia chemiczne. Materia składa się z atomów. Atomy łączą się ze sobą, tworząc cząsteczki.
Atom to najmniejsza jednostka pierwiastka, która zachowuje jego właściwości chemiczne. Przykładowo, atom wodoru (H) jest najmniejszą jednostką wodoru. Atom tlenu (O) jest najmniejszą jednostką tlenu. Różne typy atomów to różne pierwiastki chemiczne.
Cząsteczka powstaje, gdy dwa lub więcej atomów łączy się ze sobą. Te połączenia nazywamy wiązaniami chemicznymi. Cząsteczki mogą być proste, składające się z kilku atomów tego samego pierwiastka, lub złożone, składające się z wielu atomów różnych pierwiastków.
Budowa Wody (H₂O)
Woda jest związkiem chemicznym. Jej cząsteczka składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O). Stąd jej wzór chemiczny to H₂O.
Dwa atomy wodoru są połączone z atomem tlenu poprzez wiązania kowalencyjne. Oznacza to, że atomy wodoru i tlenu dzielą się elektronami. Układ tych atomów nie jest liniowy, ale tworzy kąt. Kąt między atomami wodoru wynosi około 104,5 stopnia. Ta kątowa budowa cząsteczki wody ma istotne konsekwencje dla jej właściwości.
Dzięki tej kątowej budowie i różnicy w elektroujemności (zdolności do przyciągania elektronów) między tlenem a wodorem, cząsteczka wody jest polarna. Oznacza to, że ma ona częściowy ładunek ujemny na atomie tlenu i częściowe ładunki dodatnie na atomach wodoru. Polarność cząsteczki wody powoduje, że woda jest doskonałym rozpuszczalnikiem dla wielu substancji.
Para Wodna – Woda w Stanie Gazowym
Para wodna to woda w stanie gazowym. Nadal jest zbudowana z cząsteczek H₂O. Różnica między wodą ciekłą a parą wodną polega na energii kinetycznej cząsteczek oraz na odległościach między nimi.
W wodzie ciekłej, cząsteczki H₂O są blisko siebie i połączone stosunkowo silnymi wiązaniami wodorowymi. Wiązania wodorowe powstają dzięki polarności cząsteczek wody – częściowo dodatnie atomy wodoru jednej cząsteczki przyciągają częściowo ujemny atom tlenu innej cząsteczki. Te wiązania wodorowe są słabsze niż wiązania kowalencyjne wewnątrz cząsteczki, ale wystarczająco silne, aby utrzymać cząsteczki blisko siebie.
W parze wodnej cząsteczki H₂O mają znacznie więcej energii kinetycznej i poruszają się znacznie szybciej. Odległości między nimi są większe, a wiązania wodorowe są zrywane. Para wodna zachowuje się bardziej jak idealny gaz, a jej cząsteczki poruszają się swobodnie w przestrzeni.
Przejścia Fazowe: Od Lodu do Pary
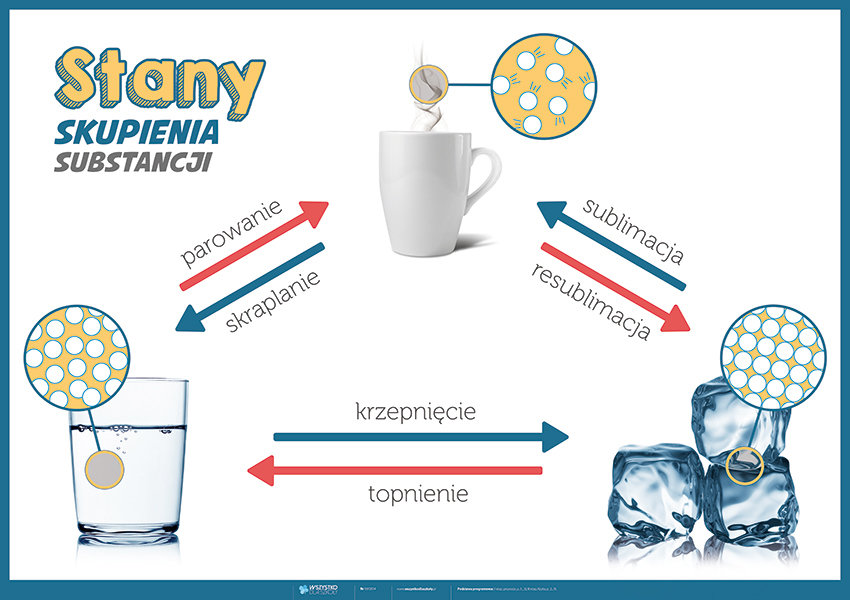
Woda może występować w trzech stanach skupienia: stałym (lód), ciekłym (woda) i gazowym (para wodna). Przejścia między tymi stanami skupienia nazywamy przemianami fazowymi.
Aby przejść z lodu do wody (topnienie), należy dostarczyć energię, która osłabi wiązania wodorowe i pozwoli cząsteczkom poruszać się swobodniej. Aby przejść z wody do pary wodnej (parowanie), należy dostarczyć jeszcze więcej energii, aby zerwać wiązania wodorowe i pozwolić cząsteczkom H₂O na swobodne poruszanie się w przestrzeni.
Odwrotne procesy – zamarzanie (woda do lodu) i kondensacja (para wodna do wody) – zachodzą, gdy energia jest odprowadzana z układu. Wówczas cząsteczki zwalniają, a wiązania wodorowe ponownie się tworzą.
Znaczenie Wody i Pary Wodnej
Woda jest niezbędna do życia. Jest głównym składnikiem organizmów żywych i bierze udział w wielu procesach biologicznych. Jako rozpuszczalnik, ułatwia transport substancji odżywczych i usuwanie odpadów.
Para wodna odgrywa kluczową rolę w cyklu hydrologicznym. Parowanie wody z powierzchni oceanów, jezior i rzek, a także z roślin (transpiracja), prowadzi do powstania chmur i opadów. Para wodna jest również gazem cieplarnianym, który wpływa na klimat Ziemi.
Zrozumienie budowy wody i pary wodnej, ich właściwości oraz roli w przyrodzie jest fundamentalne dla wielu dziedzin nauki, od chemii i biologii po meteorologię i inżynierię środowiska. Znajomość tych podstaw pozwala lepiej zrozumieć świat wokół nas.