Witajcie, nauczyciele chemii! Porozmawiajmy dzisiaj o wiązaniach sigma (σ) i pi (π). Są to fundamentalne koncepcje w chemii organicznej. Często sprawiają one trudności uczniom.
Czym są Wiązania Sigma i Pi?
Wiązania sigma (σ) powstają w wyniku czołowego nakładania się orbitali atomowych. Jest to najbardziej bezpośredni sposób na połączenie dwóch atomów. Wyobraźcie sobie dwie osoby ściskające sobie dłonie – to obrazuje czołowe nakładanie.
Wiązania pi (π) powstają w wyniku bocznego nakładania się orbitali atomowych. Nakładanie boczne jest mniej efektywne niż czołowe. Wiązanie pi jest słabsze niż wiązanie sigma.
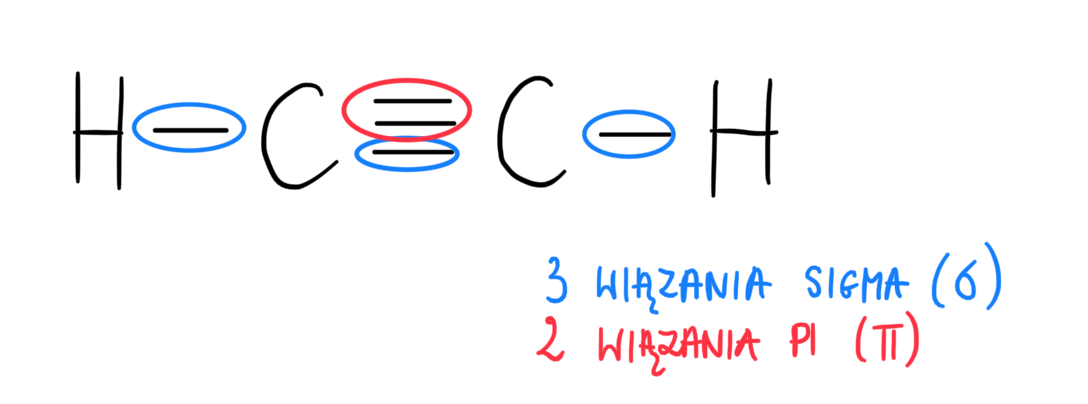
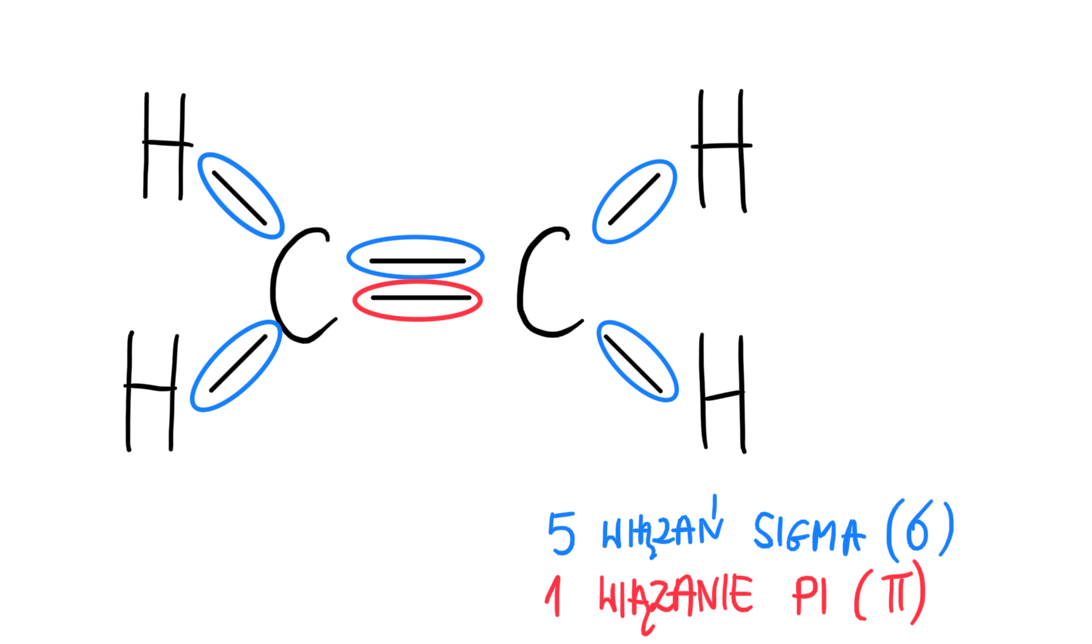
Zazwyczaj pojedyncze wiązanie jest wiązaniem sigma. Podwójne wiązanie składa się z jednego wiązania sigma i jednego wiązania pi. Potrójne wiązanie to jedno wiązanie sigma i dwa wiązania pi.
Jak Wyjaśnić to w Klasie?
Użyjcie modeli! Modele molekularne są bardzo pomocne. Uczniowie mogą dotknąć i zobaczyć, jak orbitale się nakładają. Wizualizacje komputerowe to kolejna opcja.
Analogia ze ściskaniem dłoni jest łatwa do zapamiętania. Czołowe nakładanie (sigma) to mocny uścisk dłoni. Boczne nakładanie (pi) to słabszy kontakt, np. dotknięcie bokiem dłoni.
Zacznijcie od prostych cząsteczek. Na przykład, omówcie wiązania w etanie (C2H6), etenie (C2H4) i etynie (C2H2). To pokaże różnicę między pojedynczymi, podwójnymi i potrójnymi wiązaniami.
Wykorzystajcie interaktywne quizy i zadania. Sprawdźcie, czy uczniowie rozumieją, ile wiązań sigma i pi znajduje się w różnych cząsteczkach. Możecie użyć aplikacji online lub przygotować karty pracy.
Typowe Błędy Uczniów
Uczniowie często myślą, że każde wiązanie to wiązanie sigma. Muszą zrozumieć, że podwójne i potrójne wiązania mają również wiązania pi. Podkreślcie, że wiązanie sigma jest zawsze pierwsze.
Inny błąd to mylenie siły wiązań. Wiązania pi są słabsze niż wiązania sigma. Nie oznacza to, że podwójne wiązanie jest słabsze niż pojedyncze. Podwójne wiązanie jest mocniejsze, ponieważ składa się z wiązania sigma i pi.
Uczniowie mogą mieć trudności z wizualizacją nakładania się orbitali. Użyjcie rysunków i animacji, aby pokazać, jak orbitale się stykają. Wyjaśnijcie, że orbitale p nakładają się bokiem, tworząc wiązanie pi.
Jak Uatrakcyjnić Lekcję?
Zorganizujcie konkurs na modelowanie cząsteczek. Uczniowie mogą budować modele z gliny, piłeczek pingpongowych lub zestawów do modelowania. To pomoże im wizualizować wiązania.
Stwórzcie zadanie grupowe. Uczniowie analizują różne cząsteczki i określają liczbę wiązań sigma i pi. Następnie prezentują swoje wyniki klasie.
Wykorzystajcie analogie z życia codziennego. Na przykład, porównajcie wiązanie sigma do fundamentu budynku, a wiązanie pi do dodatkowych elementów wzmacniających. To pomoże uczniom zrozumieć znaczenie różnych rodzajów wiązań.
Wprowadźcie elementy grywalizacji. Użyjcie kart, gdzie każda karta przedstawia cząsteczkę. Uczniowie losują kartę i muszą szybko określić liczbę wiązań sigma i pi. Za poprawne odpowiedzi przyznawajcie punkty.
Podsumowanie
Wiązania sigma i pi są kluczowe dla zrozumienia struktury i właściwości molekuł. Użyjcie modeli, analogii i interaktywnych zadań, aby uczynić ten temat bardziej przystępnym. Pomagajcie uczniom przezwyciężać typowe błędy.
Pamiętajcie, że cierpliwość i różnorodne metody nauczania są kluczem do sukcesu. Życzę powodzenia w nauczaniu tego fascynującego tematu!
Dodatkowe wskazówki:
Rozważcie wprowadzenie koncepcji hybrydyzacji orbitalnej. To pomoże uczniom zrozumieć, dlaczego atomy węgla tworzą cztery wiązania. Hybrydyzacja sp3 prowadzi do wiązań sigma, a hybrydyzacja sp2 i sp prowadzi do wiązań sigma i pi.
Podkreślcie wpływ wiązań pi na reaktywność cząsteczek. Wiązania pi są bardziej reaktywne niż wiązania sigma. Są one łatwiej atakowane przez reagenty chemiczne.
Zwróćcie uwagę na rotację wokół wiązań. Rotacja wokół wiązania pojedynczego (sigma) jest możliwa. Rotacja wokół wiązania podwójnego (sigma + pi) jest ograniczona. To ma wpływ na izomerię geometryczną.