Cząsteczki budujące otaczający nas świat utrzymują się razem dzięki różnym typom wiązań chemicznych. Jednym z najważniejszych jest wiązanie kowalencyjne. Zrozumienie, jak powstaje i na czym polega, to klucz do zrozumienia wielu zjawisk w chemii.
Co to jest wiązanie kowalencyjne?
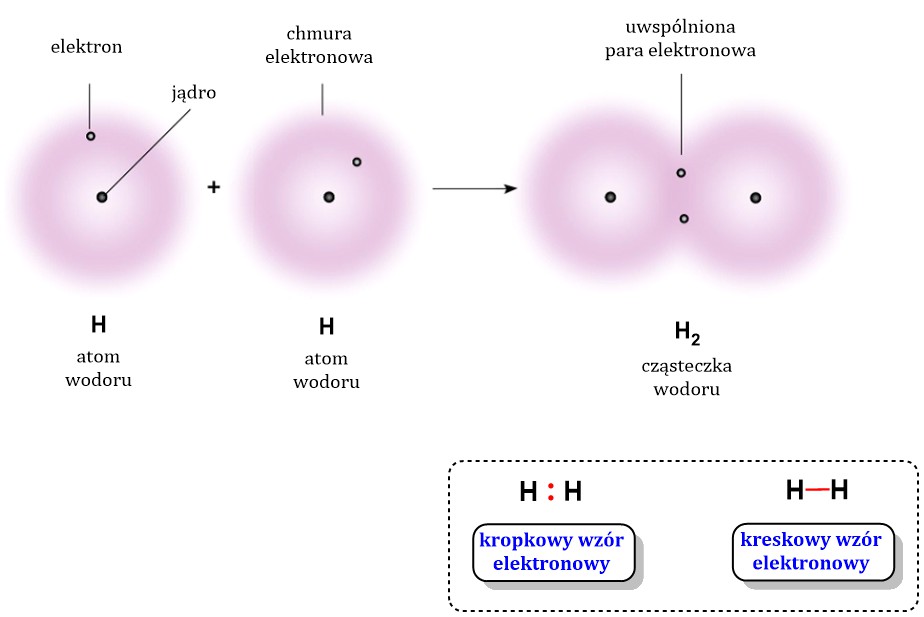
Wiązanie kowalencyjne powstaje, gdy atomy dzielą się elektronami. Zamiast oddawać lub przyjmować elektrony (jak w wiązaniu jonowym), atomy współdzielą pary elektronowe. Dzięki temu każdy z atomów zyskuje korzystną konfigurację elektronową, zwykle odpowiadającą konfiguracji gazu szlachetnego.
Pomyśl o tym jak o wspólnym skarbcu. Dwa atomy mają ograniczoną liczbę elektronów. Zamiast je tracić lub zyskiwać w całości, decydują się je "współdzielić". Wspólne elektrony krążą wokół obu atomów, tworząc wiązanie.
Jak powstaje wiązanie kowalencyjne?
Atomy zbliżają się do siebie. Ich orbitale atomowe (obszary, w których prawdopodobnie znajdują się elektrony) zaczynają się nakładać. Elektrony, które mają niesparowane spiny, parują się i tworzą orbital molekularny. Orbital molekularny obejmuje oba atomy.
Elektrony w orbitalu molekularnym są przyciągane przez jądra obu atomów. To przyciąganie przeciwdziała odpychaniu między jądrami i między elektronami. Powstaje stabilna konfiguracja, którą nazywamy wiązaniem kowalencyjnym. Energia potencjalna układu jest niższa, niż gdyby atomy były oddzielone.
Rodzaje wiązań kowalencyjnych
Wiązania kowalencyjne mogą być pojedyncze, podwójne lub potrójne. Liczba wiązań zależy od liczby elektronów, które atomy muszą współdzielić, aby osiągnąć stabilną konfigurację elektronową.
- Wiązanie pojedyncze powstaje, gdy atomy współdzielą jedną parę elektronów (np. w cząsteczce wodoru, H2).
- Wiązanie podwójne powstaje, gdy atomy współdzielą dwie pary elektronów (np. w cząsteczce tlenu, O2).
- Wiązanie potrójne powstaje, gdy atomy współdzielą trzy pary elektronów (np. w cząsteczce azotu, N2).
Im więcej par elektronów współdzielonych, tym silniejsze i krótsze jest wiązanie.
Elektroujemność
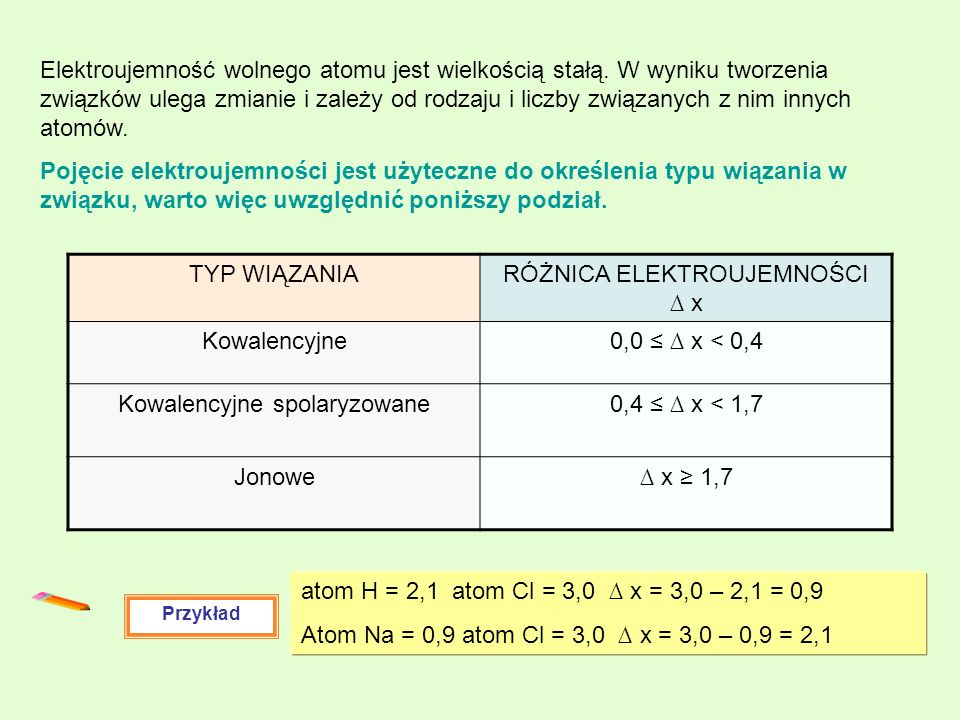
Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Atomy o wysokiej elektroujemności silniej przyciągają elektrony niż atomy o niskiej elektroujemności.
Elektroujemność rośnie w układzie okresowym od lewej do prawej oraz od dołu do góry. Fluor (F) jest najbardziej elektroujemnym pierwiastkiem, a cez (Cs) jest najmniej elektroujemnym pierwiastkiem (pomijając gazy szlachetne).
Wiązania kowalencyjne polarne i niepolarne
Różnica w elektroujemności między atomami w wiązaniu kowalencyjnym decyduje o jego charakterze. Jeśli atomy mają podobną elektroujemność, elektrony są współdzielone równomiernie i powstaje wiązanie kowalencyjne niepolarne. Przykładem jest wiązanie w cząsteczce wodoru (H2) lub w cząsteczce metanu (C-H).
Jeśli jeden atom ma znacznie wyższą elektroujemność niż drugi, elektrony są przesunięte w jego stronę. Powstaje wiązanie kowalencyjne polarne. Atom o wyższej elektroujemności ma częściowy ładunek ujemny (δ-), a atom o niższej elektroujemności ma częściowy ładunek dodatni (δ+).
Przykładem wiązania kowalencyjnego polarnego jest wiązanie w cząsteczce wody (H2O). Tlen jest bardziej elektroujemny niż wodór, więc elektrony są przesunięte w stronę tlenu. Tlen ma częściowy ładunek ujemny, a wodory mają częściowe ładunki dodatnie.
Wpływ polarności wiązań na właściwości substancji
Polarność wiązań ma ogromny wpływ na właściwości fizyczne i chemiczne substancji. Cząsteczki polarne oddziałują ze sobą silniej niż cząsteczki niepolarne. To wpływa na temperaturę wrzenia, temperaturę topnienia, rozpuszczalność i inne właściwości.
Na przykład, woda (H2O) jest cieczą w temperaturze pokojowej, podczas gdy metan (CH4) jest gazem. Woda jest polarna, a metan niepolarny. Silniejsze oddziaływania między cząsteczkami wody powodują, że potrzebna jest więcej energii, aby je rozerwać i przejść w stan gazowy.
Przykłady i zastosowania
Wiązania kowalencyjne są wszechobecne w chemii organicznej i nieorganicznej. Budują podstawowe cząsteczki życia, takie jak białka, węglowodany i tłuszcze. Są również obecne w wielu materiałach przemysłowych, takich jak tworzywa sztuczne, polimery i włókna.
Zrozumienie natury wiązań kowalencyjnych pozwala nam projektować i syntetyzować nowe materiały o pożądanych właściwościach. Możemy przewidywać, jak cząsteczki będą oddziaływać ze sobą i jakie będą ich właściwości fizyczne i chemiczne. Wiązania kowalencyjne są fundamentalne dla chemii i mają ogromny wpływ na nasze codzienne życie.