Drodzy nauczyciele chemii,
Omawiam z Wami dziś temat wiązań chemicznych. Konkretnie – wiązania jonowe, kowalencyjne spolaryzowane i niespolaryzowane.
To kluczowy temat. Zrozumienie go jest fundamentem dalszej nauki chemii.
Wiązania Jonowe
Zacznijmy od wiązań jonowych.
Powstają one pomiędzy atomami o znacznej różnicy elektroujemności.
Jeden atom oddaje elektron. Drugi go przyjmuje.
Powstają jony – kation (ładunek dodatni) i anion (ładunek ujemny).
Przyciąganie elektrostatyczne tych jonów to właśnie wiązanie jonowe.
Jak to wytłumaczyć uczniom? Użyjmy przykładu chlorku sodu (NaCl).
Sód (Na) łatwo oddaje elektron. Chlor (Cl) chętnie go przyjmuje.
Można użyć wizualizacji. Na przykład kulek reprezentujących atomy. Jedną kulkę przekazujemy drugiej.
Podkreślmy, że powstają jony Na+ i Cl-.
Zwróćmy uwagę na ich ładunki.
Typowe Misconceptions
Uczniowie często myślą, że wiązanie jonowe to fizyczne połączenie. Jakby atomy były "złączone" ze sobą.
Wyjaśnijmy, że to przyciąganie elektrostatyczne utrzymuje jony blisko siebie.
Inny błąd: mylenie wiązań jonowych z wiązaniami kowalencyjnymi.
Podkreślmy różnicę w różnicy elektroujemności.
Wiązania Kowalencyjne
Przejdźmy do wiązań kowalencyjnych.
Powstają przez uwspólnienie elektronów.
Atomy "dzielą się" elektronami, aby uzyskać stabilną konfigurację elektronową.
Mamy dwa typy: spolaryzowane i niespolaryzowane.
Wiązania Kowalencyjne Niespolaryzowane
Występują, gdy atomy mają bardzo podobną elektroujemność.
Elektrony są równomiernie rozłożone między atomami.
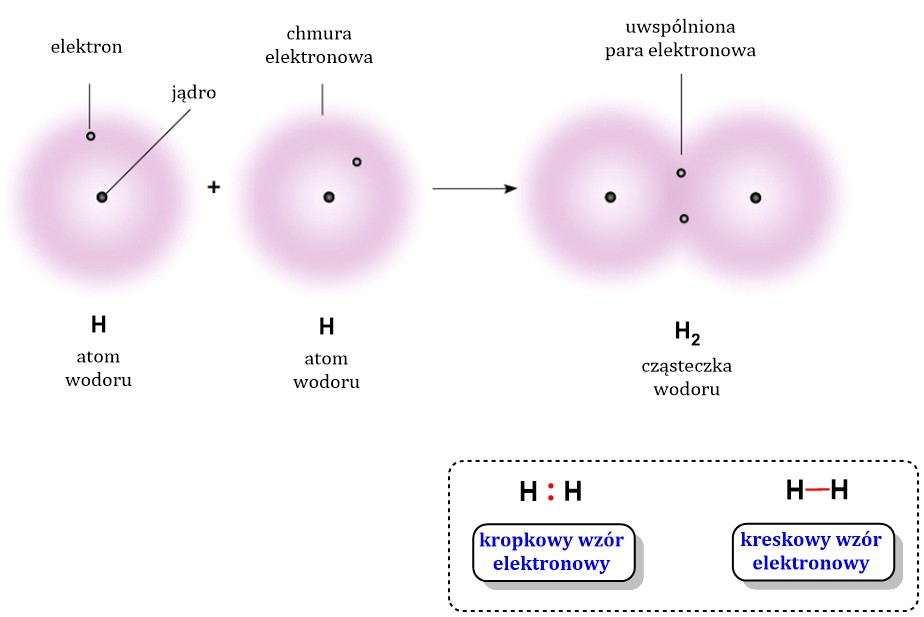
Przykład: cząsteczka wodoru (H2).
Oba atomy wodoru mają taką samą elektroujemność.
Elektrony są "po równo" między nimi.
Inne przykłady: O2, N2.
Wiązania Kowalencyjne Spolaryzowane
Powstają, gdy atomy mają różną elektroujemność, ale nie tak dużą jak w wiązaniu jonowym.
Elektrony są przesunięte w stronę bardziej elektroujemnego atomu.
Powstaje cząstkowy ładunek ujemny (δ-) na atomie bardziej elektroujemnym.
I cząstkowy ładunek dodatni (δ+) na atomie mniej elektroujemnym.
Przykład: woda (H2O).
Tlen (O) jest bardziej elektroujemny niż wodór (H).
Elektrony są przesunięte w stronę tlenu.
Tlen ma cząstkowy ładunek ujemny. Wodory mają cząstkowe ładunki dodatnie.
Można to przedstawić za pomocą strzałki skierowanej w stronę bardziej elektroujemnego atomu.
Jak to wytłumaczyć uczniom? Porównajmy do przeciągania liny.
Wiązanie niespolaryzowane to jak dwóch silnych zawodników. Lina jest pośrodku.
Wiązanie spolaryzowane to jak jeden silny i jeden słaby zawodnik. Lina jest przesunięta w stronę silniejszego.
Typowe Misconceptions
Uczniowie mylą spolaryzowane wiązania kowalencyjne z wiązaniami jonowymi.
Podkreślmy, że w wiązaniach spolaryzowanych elektrony są nadal uwspólniane. Nie są całkowicie oddawane.
Inny błąd: brak zrozumienia koncepcji elektroujemności.
Wytłumaczmy, że elektroujemność to miara zdolności atomu do przyciągania elektronów.
Jak Uatrakcyjnić Naukę?
Używajmy modeli. Zarówno fizycznych, jak i komputerowych.
Stwórzmy zadania grupowe. Uczniowie mogą tworzyć modele cząsteczek i określać typ wiązania.
Wykorzystajmy analogie. Tak jak przykład z przeciąganiem liny.
Zorganizujmy quizy. Sprawdźmy, czy uczniowie rozumieją różnice między typami wiązań.
Pokażmy praktyczne zastosowania. Wiązania chemiczne wpływają na właściwości substancji. Na przykład na temperaturę wrzenia i rozpuszczalność.
Podsumowując:
Wiązania jonowe: Oddawanie i przyjmowanie elektronów.
Wiązania kowalencyjne niespolaryzowane: Równomierne uwspólnianie elektronów.
Wiązania kowalencyjne spolaryzowane: Nierównomierne uwspólnianie elektronów.
Pamiętajmy o powtarzaniu i utrwalaniu wiedzy.
Życzę owocnej pracy!