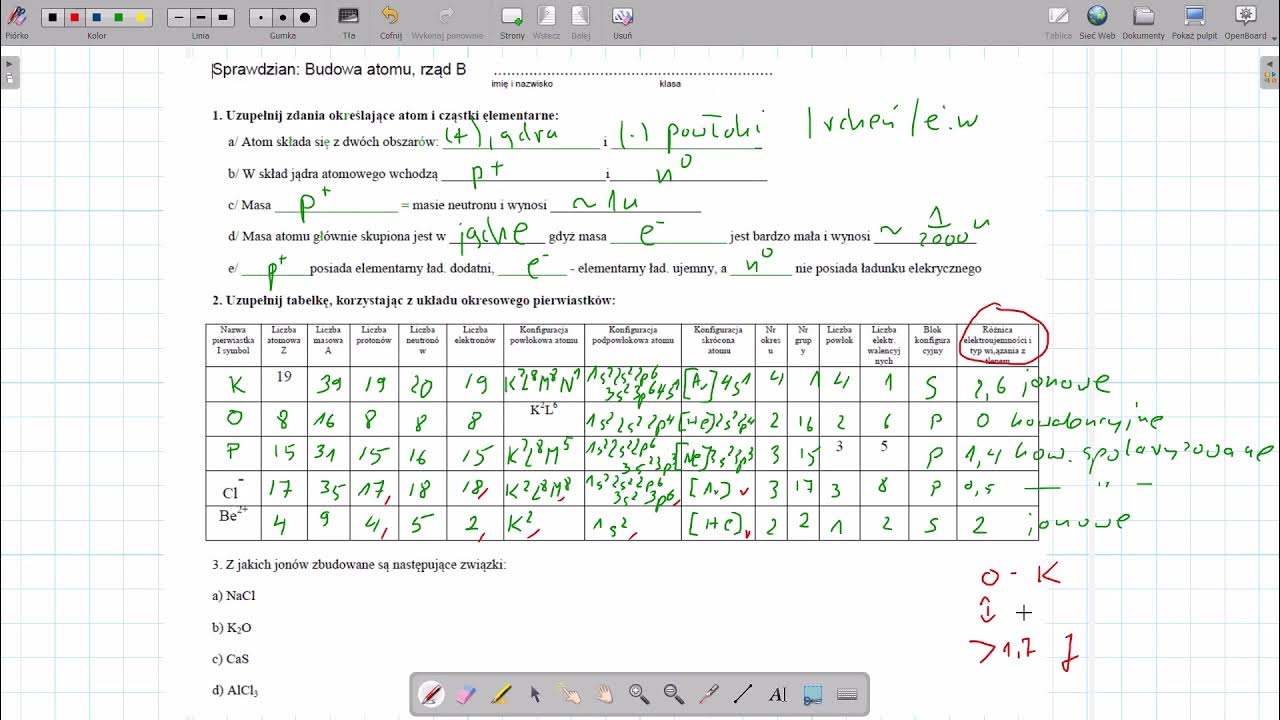
Witajcie, młodzi chemicy! Przygotujcie się na sprawdzian z wiązań chemicznych. To fascynujący temat. Wyobraźcie sobie, że to klocki LEGO, ale zamiast plastiku, używamy atomów!
Co to w ogóle są wiązania chemiczne?
To siły, które trzymają atomy razem. Pomyślcie o magnesach. Mają bieguny. Atomy też mają coś podobnego, co je przyciąga.
Dzięki temu powstają cząsteczki. Woda (H₂O) to cząsteczka. Dwa atomy wodoru i jeden atom tlenu trzymają się razem. To jak drużyna!
Dlaczego atomy się łączą?
Atomy chcą być stabilne. Wyobraźcie sobie, że to jak krzesło. Chcą mieć "pełne" krzesło elektronów. To jak mieć wszystko, czego potrzebują. Reguła oktetu (8 elektronów na powłoce walencyjnej) to taka meta.
Dlatego oddają lub dzielą się elektronami. Żeby osiągnąć upragnioną stabilność. To jak dzielenie się zabawkami z przyjaciółmi, żeby każdy był zadowolony.
Rodzaje wiązań chemicznych
Mamy kilka głównych rodzajów. Każdy z nich jest trochę inny. To jak różne sposoby budowania z LEGO.
Wiązanie jonowe
Wyobraźcie sobie, że jeden atom *kradnie* elektron drugiemu. Tak naprawdę to oddaje go na stałe. Jeden staje się naładowany dodatnio (kation). Drugi staje się naładowany ujemnie (anion).
Naładowane jony się przyciągają. Jak magnesy z różnymi biegunami. Tworzą kryształ. Sól kuchenna (NaCl) to świetny przykład. Sód (Na) oddaje elektron chlorowi (Cl).
Pomyślcie o tym jak o oddawaniu kurtki komuś, kto marznie. Jeden zyskuje ciepło (stabilność), a drugi oddaje kurtkę.
Wiązanie kowalencyjne
Tutaj atomy dzielą się elektronami. To bardziej jak współpraca niż kradzież. Każdy atom wnosi coś od siebie.
Wyobraźcie sobie, że macie wspólną zabawkę. Oboje się nią bawicie. To sprawiedliwe.
Woda (H₂O) to przykład. Atom tlenu dzieli się elektronami z dwoma atomami wodoru. Wszyscy są szczęśliwi.
Mamy dwa rodzaje wiązań kowalencyjnych: *spolaryzowane* i *niespolaryzowane*.
Wiązanie kowalencyjne niespolaryzowane
Elektrony są dzielone równo. Jak dzielenie pizzy na pół. Oboje dostajecie po równo.
Przykładem jest cząsteczka wodoru (H₂). Dwa atomy wodoru dzielą się elektronami dokładnie po równo.
Wiązanie kowalencyjne spolaryzowane
Jeden atom "ciągnie" elektrony bardziej niż drugi. To jak silniejszy kolega, który chce mieć więcej pizzy.
Powstają wtedy ładunki częściowe. Jeden atom ma mały ładunek ujemny (δ-). Drugi ma mały ładunek dodatni (δ+).
Woda (H₂O) to przykład. Tlen jest bardziej elektroujemny niż wodór. Ciągnie elektrony do siebie. Dlatego tlen ma mały ładunek ujemny, a wodory - małe ładunki dodatnie.
Wiązanie metaliczne
To wiązanie występuje w metalach. Wyobraźcie sobie "morze" elektronów. Elektrony nie należą do konkretnego atomu. Swobodnie się poruszają.
To dlatego metale przewodzą prąd. Elektrony mogą łatwo się przemieszczać. To jak ruchliwe, taneczne elektrony!
Wyobraźcie sobie boisko pełne piłek (elektronów). Każdy może wziąć piłkę i biegać. To właśnie wiązanie metaliczne.
Jak rozpoznać rodzaj wiązania?
Sprawdź różnicę w elektroujemności między atomami. To jak siła przyciągania elektronów.
Duża różnica elektroujemności – wiązanie jonowe.
Mała różnica elektroujemności – wiązanie kowalencyjne.
Brak różnicy elektroujemności – wiązanie kowalencyjne niespolaryzowane.
Pamiętajcie o układzie okresowym. Elektroujemność rośnie od lewej do prawej i od dołu do góry. To jak mapa skarbów elektroujemności!
Podsumowanie
Wiązania chemiczne to siły, które łączą atomy. Dzięki nim powstają cząsteczki. Mamy różne rodzaje wiązań: jonowe, kowalencyjne (spolaryzowane i niespolaryzowane) i metaliczne.
Pamiętajcie o elektroujemności. To klucz do rozpoznawania rodzajów wiązań.
Powodzenia na sprawdzianie! Pomyślcie o LEGO, magnesach i pizzy. To ułatwi zrozumienie tematu.