Hej Studencie! Zastanawiałeś się kiedyś, co się dzieje wewnątrz baterii, kiedy ją używasz? A może słyszałeś o elektrolizie, ale nie do końca rozumiesz, na czym to polega? Spokojnie, zaraz to rozjaśnimy!
Porozmawiamy o tym, który elektroda staje się cięższa podczas elektrolizy. Będziemy krok po kroku rozkładać ten temat na mniejsze części.
Elektroliza: Podstawy
Na początek, czym właściwie jest elektroliza? Wyobraź sobie, że masz pewną substancję, na przykład wodę z solą. Elektroliza to proces rozkładania tej substancji za pomocą prądu elektrycznego.
Mówiąc prościej, wykorzystujemy energię elektryczną, aby wywołać reakcję chemiczną, która normalnie by nie zaszła.
Elementy Elektrolizy
Do przeprowadzenia elektrolizy potrzebujemy kilku kluczowych elementów:
- Elektrolit: To substancja, która przewodzi prąd elektryczny, gdy jest rozpuszczona w wodzie lub stopiona. Przykładem jest roztwór soli kuchennej (NaCl) w wodzie.
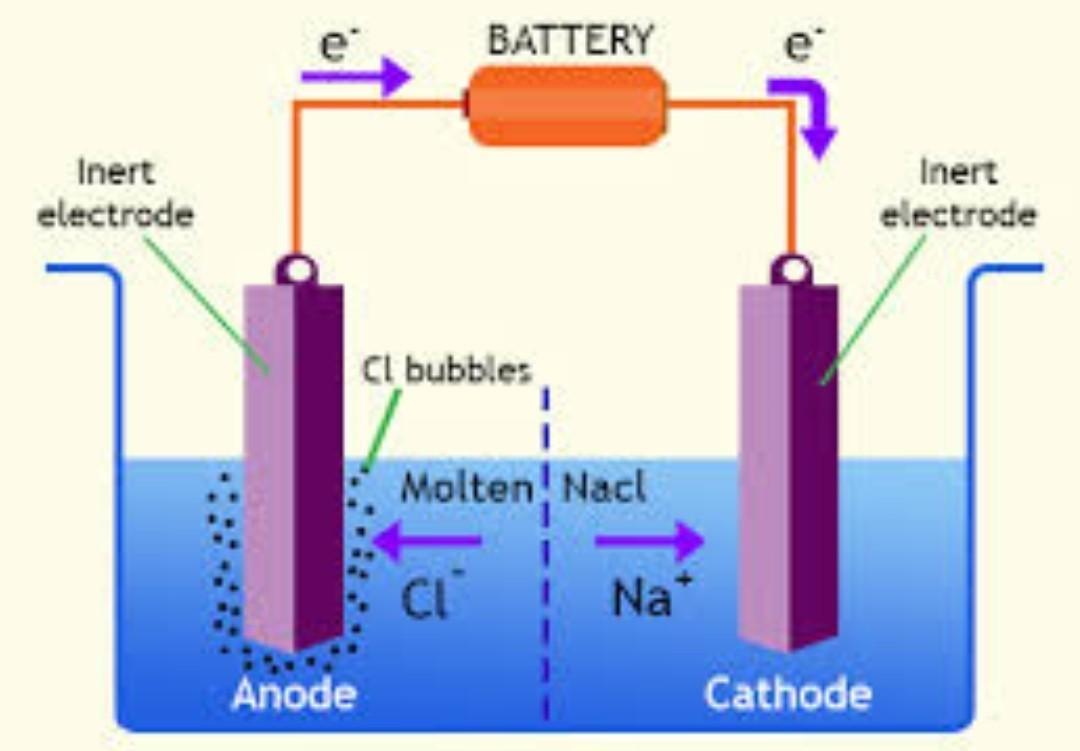
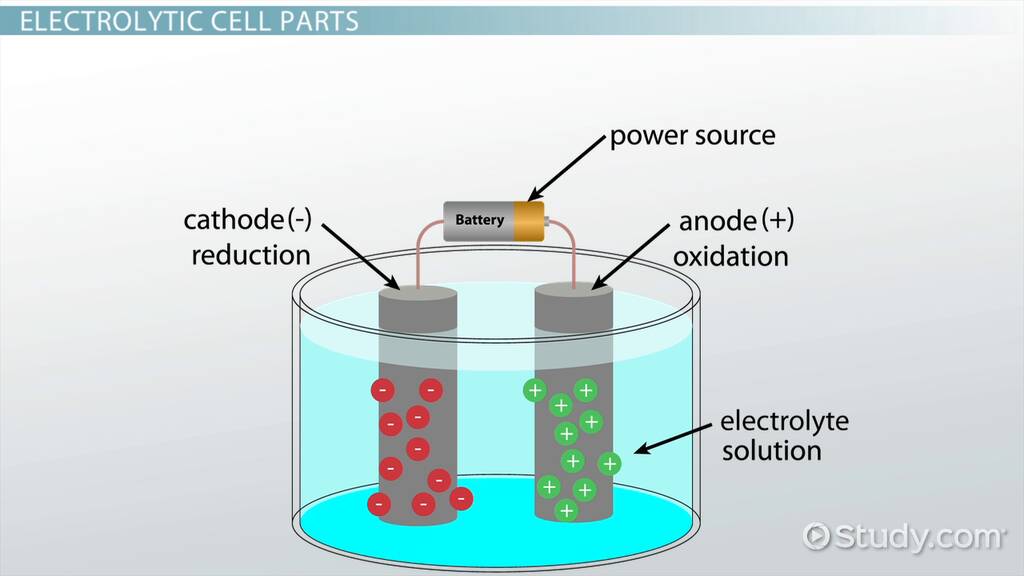
- Elektrody: To przewodniki (zwykle metalowe lub grafitowe), przez które prąd elektryczny wchodzi do elektrolitu i z niego wychodzi. Mamy dwie elektrody: anodę i katodę.
- Źródło prądu stałego: Potrzebujemy czegoś, co dostarczy prąd, na przykład bateria lub zasilacz.
Anoda i Katoda: Dwie Różne Role
Anoda to elektroda, która jest podłączona do dodatniego bieguna źródła prądu. Na anodzie zachodzi proces utleniania. To oznacza, że substancje oddają elektrony.
Katoda to elektroda, która jest podłączona do ujemnego bieguna źródła prądu. Na katodzie zachodzi proces redukcji. To oznacza, że substancje przyjmują elektrony.
Pamiętaj: Anoda - utlenianie, Katoda - redukcja (można zapamiętać skrótowiec "AnOx RedCat", gdzie An - anoda, Ox - utlenianie, Red - redukcja, Cat - katoda).
Jak to Działa?
Wyobraź sobie, że masz roztwór chlorku miedzi (CuCl2) w wodzie. Zanurzamy w nim dwie elektrody: anodę i katodę, i podłączamy je do źródła prądu.
W roztworze chlorku miedzi mamy jony miedzi (Cu2+) i jony chlorkowe (Cl-).
Co się dzieje na anodzie? Jony chlorkowe (Cl-) oddają elektrony i przekształcają się w gazowy chlor (Cl2). Reakcja wygląda następująco: 2Cl- → Cl2 + 2e-.
Co się dzieje na katodzie? Jony miedzi (Cu2+) przyjmują elektrony i przekształcają się w metaliczną miedź (Cu). Reakcja wygląda następująco: Cu2+ + 2e- → Cu.
Zauważ, że metaliczna miedź osadza się na katodzie.
Która Elektroda Staje się Cięższa?
Wróćmy do pytania z początku: która elektroda staje się cięższa podczas elektrolizy?
Odpowiedź brzmi: katoda.
Dlaczego? Ponieważ na katodzie zachodzi redukcja, czyli jony metalu (w naszym przykładzie miedzi) z roztworu osadzają się na elektrodzie w postaci metalu. Metal "dokleja się" do katody, powodując jej wzrost masy.
Na anodzie zwykle zachodzi utlenianie, co często prowadzi do uwalniania gazów (jak chlor w naszym przykładzie) lub rozpuszczania się elektrody, a więc jej ubytku masy.
Przykłady z Życia Codziennego
Elektroliza ma wiele zastosowań w życiu codziennym i przemyśle. Oto kilka przykładów:
- Oczyszczanie metali: Elektroliza jest wykorzystywana do oczyszczania miedzi, aluminium i innych metali. Zanieczyszczony metal stanowi anodę, a czysty metal osadza się na katodzie.
- Elektroplaterowanie (galwanizacja): Elektroliza jest używana do pokrywania metali cienką warstwą innego metalu. Na przykład, chromowanie samochodowych zderzaków lub pokrywanie sztućców srebrem.
- Produkcja chloru i wodorotlenku sodu: Elektroliza roztworu soli kuchennej (NaCl) jest wykorzystywana do produkcji chloru (Cl2), wodorotlenku sodu (NaOH) i wodoru (H2).
- Ładowanie akumulatorów: Proces ładowania akumulatora jest przykładem elektrolizy, gdzie reakcje chemiczne są odwracane za pomocą prądu elektrycznego.
Podsumowanie
Podczas elektrolizy, katoda staje się cięższa, ponieważ na niej zachodzi redukcja, czyli osadzanie się metalu z roztworu. Anoda natomiast zwykle traci masę, ponieważ zachodzi na niej utlenianie.
Zapamiętaj te kluczowe pojęcia: elektroliza, elektrolit, anoda, katoda, utlenianie, redukcja.
Teraz, gdy wiesz, jak to działa, możesz spojrzeć na świat wokół siebie z nowej perspektywy! Powodzenia w dalszej nauce!