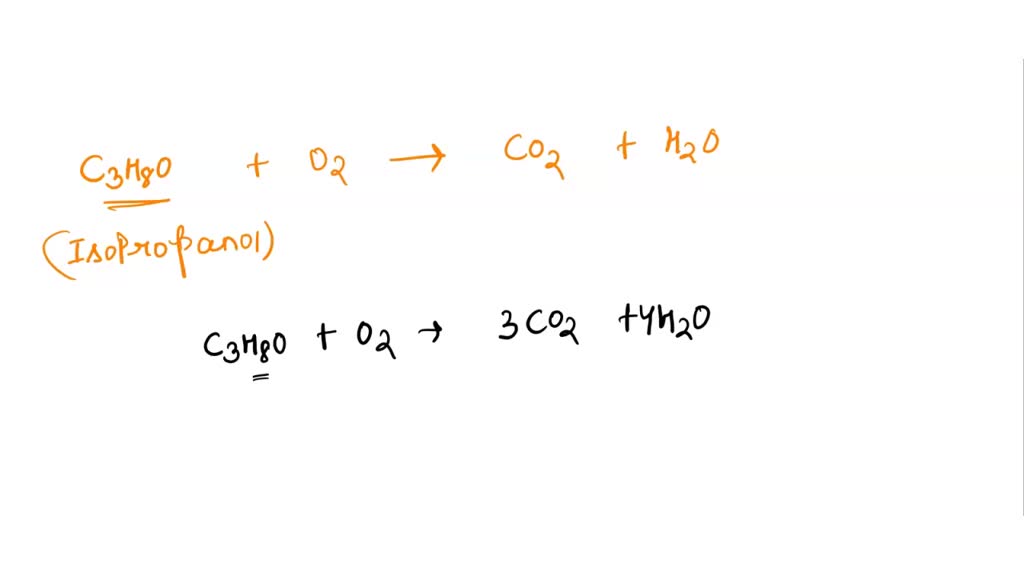Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Dzisiaj omówimy reakcję spalania izopropanolu (C3H8O) w tlenie (O2). To powszechne zadanie, więc spokojnie, razem to ogarniemy!
Spalanie Izopropanolu - Wprowadzenie
Zacznijmy od podstaw. Spalanie to reakcja chemiczna, w której substancja reaguje z utleniaczem, zwykle tlenem, wydzielając przy tym ciepło i światło. Brzmi prosto, prawda?
Izopropanol, znany też jako alkohol izopropylowy, to popularny rozpuszczalnik i środek dezynfekujący. Jego wzór to C3H8O. Pamiętaj o tym!
Tlen (O2) to gaz niezbędny do życia i... spalania. Jest wszędzie wokół nas!
Rodzaje Spalania
Istnieją różne rodzaje spalania. Ważne, żeby je rozróżniać. Mamy spalanie całkowite i niecałkowite. Zrozumienie różnicy jest kluczowe!
Spalanie Całkowite
W spalaniu całkowitym, jest wystarczająca ilość tlenu. Produktami są wtedy dwutlenek węgla (CO2) i woda (H2O). To taka "idealna" sytuacja.
Równanie reakcji wygląda tak: C3H8O + 4.5 O2 → 3 CO2 + 4 H2O + ciepło
Zauważ, że węgiel przekształca się w dwutlenek węgla, a wodór w wodę.
Spalanie Niecałkowite
Spalanie niecałkowite zachodzi, gdy brakuje tlenu. Wtedy powstają inne produkty uboczne.
Oprócz dwutlenku węgla i wody, mogą powstać: tlenek węgla (CO) i węgiel (C), czyli sadza. Tlenek węgla jest trujący! Pamiętaj o tym!
Równanie reakcji spalania niecałkowitego może wyglądać np. tak: C3H8O + 3 O2 → CO2 + CO + C + 4 H2O + ciepło
Widzisz różnicę? Mniej tlenu, inne produkty!
Jak Napisać Równanie Reakcji Spalania?
Ok, przejdźmy do praktyki. Jak napisać równanie reakcji spalania izopropanolu?
1. Zacznij od zapisania substratów, czyli izopropanolu (C3H8O) i tlenu (O2). C3H8O + O2 →
2. Następnie, zapisz produkty. W przypadku spalania całkowitego to dwutlenek węgla (CO2) i woda (H2O). C3H8O + O2 → CO2 + H2O
3. Teraz najważniejsze - bilansowanie równania! Musimy dopasować współczynniki stechiometryczne, żeby po obu stronach równania była taka sama liczba atomów każdego pierwiastka.
4. Zacznij od węgla (C). Mamy 3 atomy węgla w izopropanolu, więc dopisz 3 przed CO2: C3H8O + O2 → 3 CO2 + H2O
5. Teraz wodór (H). Mamy 8 atomów wodoru w izopropanolu, więc dopisz 4 przed H2O: C3H8O + O2 → 3 CO2 + 4 H2O
6. Na koniec tlen (O). Po prawej stronie mamy (3 x 2) + (4 x 1) = 10 atomów tlenu. Po lewej stronie mamy 1 atom tlenu w izopropanolu. Potrzebujemy 9 atomów tlenu z O2. Dzielimy 9 przez 2, bo tlen występuje jako O2: C3H8O + 4.5 O2 → 3 CO2 + 4 H2O
7. Możemy pomnożyć całe równanie przez 2, żeby pozbyć się ułamka: 2 C3H8O + 9 O2 → 6 CO2 + 8 H2O
Brawo! Równanie jest zbilansowane!
Czynniki Wpływające na Spalanie
Na przebieg spalania wpływa kilka czynników:
- Dostępność tlenu: Jak już wiesz, brak tlenu prowadzi do spalania niecałkowitego.
- Temperatura: Wyższa temperatura sprzyja szybszemu spalaniu.
- Rozdrobnienie substancji: Drobniejsze cząstki łatwiej reagują z tlenem.
Przykłady Zastosowań Spalania Izopropanolu
Spalanie izopropanolu ma wiele praktycznych zastosowań:
- Ogrzewanie: W specjalnych palnikach, np. turystycznych.
- Dezynfekcja: Spalanie usuwa bakterie i wirusy.
- Przemysł: Jako źródło energii w niektórych procesach.
Podsumowanie - Kluczowe Punkty
Powtórzmy najważniejsze informacje:
- Spalanie to reakcja z tlenem, wydzielająca ciepło i światło.
- Izopropanol (C3H8O) spala się w tlenie.
- Spalanie całkowite daje dwutlenek węgla (CO2) i wodę (H2O).
- Spalanie niecałkowite daje dodatkowo tlenek węgla (CO) i węgiel (C).
- Bilansowanie równania reakcji jest kluczowe!
- Dostępność tlenu, temperatura i rozdrobnienie wpływają na spalanie.
Mam nadzieję, że ten przewodnik był pomocny. Powodzenia na egzaminie! Pamiętaj, regularna nauka i powtarzanie materiału to klucz do sukcesu. Dasz radę!