Drogi nauczycielu chemii!
Zapewne nie raz stajesz przed wyzwaniem jasnego wytłumaczenia uczniom pojęcia wartościowości reszty kwasowej kwasu fosforowego(V). To ważny element zrozumienia wzorów sumarycznych i strukturalnych soli, a także mechanizmów reakcji chemicznych. Spróbujmy przyjrzeć się temu tematowi bliżej, aby nauczanie było jeszcze bardziej efektywne.
Wartościowość reszty kwasowej - co to właściwie jest?
Zacznijmy od podstaw. Wartościowość reszty kwasowej to liczba atomów wodoru, które zostały "odłączone" od cząsteczki kwasu. To także liczba ładunków ujemnych, którą posiada reszta kwasowa. Pamiętaj, aby pojęcie to łączyć z definicją kwasu jako donora protonów (jonów wodorowych).
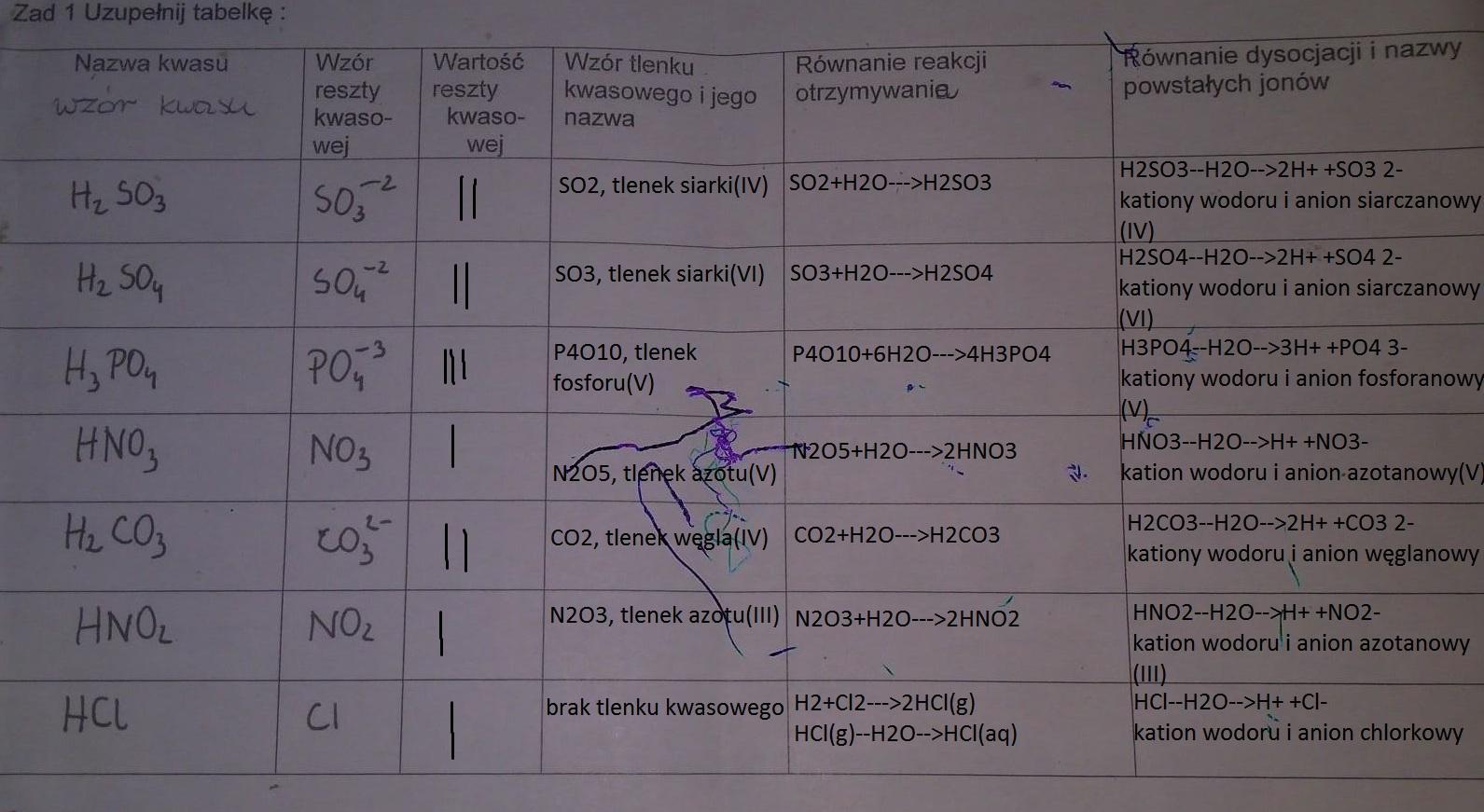
Kwas fosforowy(V), o wzorze H3PO4, jest przykładem kwasu trójprotonowego. Oznacza to, że może oddać trzy jony wodoru. Dlatego też, kwas fosforowy(V) tworzy trzy różne reszty kwasowe. Każda z nich ma inną wartościowość i tworzy różne sole.
Reszty kwasowe kwasu fosforowego(V) - krok po kroku
Pierwsza reszta kwasowa powstaje, gdy kwas fosforowy(V) oddaje jeden jon wodoru. Powstaje wtedy jon H2PO4-, zwany dihydrogenofosforanem(V). Jego wartościowość wynosi 1. Przykładowa sól to diwodoroortofosforan(V) sodu, NaH2PO4.
Druga reszta kwasowa powstaje, gdy kwas fosforowy(V) oddaje dwa jony wodoru. Powstaje wtedy jon HPO42-, zwany monowodorofosforanem(V). Jego wartościowość wynosi 2. Przykładowa sól to monowodoroortofosforan(V) wapnia, CaHPO4.
Trzecia reszta kwasowa powstaje, gdy kwas fosforowy(V) oddaje wszystkie trzy jony wodoru. Powstaje wtedy jon PO43-, zwany fosforanem(V) (ortofosforanem(V)). Jego wartościowość wynosi 3. Przykładowa sól to fosforan(V) wapnia, Ca3(PO4)2.
Jak to efektywnie wytłumaczyć w klasie?
Zacznij od wizualizacji. Użyj modeli cząsteczek lub rysunków, aby pokazać proces odłączania jonów wodoru od kwasu fosforowego(V). Możesz nawet użyć kolorowych magnesów, gdzie każdy kolor reprezentuje inny atom.
Następnie, stopniowo wprowadzaj pojęcia: kwas wieloprotonowy, reszta kwasowa i wartościowość. Staraj się używać prostego języka i odnosić się do znanych uczniom przykładów. Możesz nawiązać do kwasu solnego (HCl) i siarkowego(VI) (H2SO4) dla porównania. Pamiętaj, ze wzór ogólny soli to metal i reszta kwasowa, więc wyjaśnij to bardzo dokładnie.
Wyjaśnij, że wartościowość reszty kwasowej wpływa na stosunek jonów w soli. Pokaż, jak zmienia się wzór sumaryczny soli w zależności od reszty kwasowej. Kluczowe jest, aby uczniowie potrafili napisać wzór sumaryczny soli na podstawie wartościowości metalu i reszty kwasowej.
Typowe błędy i jak ich unikać
Uczniowie często mylą wartościowość atomu z wartościowością reszty kwasowej. Wyjaśnij, że wartościowość reszty kwasowej odnosi się do całej grupy atomów, a nie tylko pojedynczego atomu.
Inny błąd to zapominanie o ładunku elektrycznym reszty kwasowej. Podkreślaj, że każda reszta kwasowa ma ujemny ładunek, który równy jest jej wartościowości. Pamiętaj, że ładunek reszty kwasowej jest równie ważny, jak jej wartościowość.
Często uczniowie mają problem z nazwaniem soli. Wyjaśnij, że nazwa soli pochodzi od nazwy metalu i nazwy reszty kwasowej. Upewnij się, że uczniowie znają nazwy reszt kwasowych kwasu fosforowego(V): diwodoroortofosforan(V), monowodoroortofosforan(V), ortofosforan(V).
Jak uatrakcyjnić lekcję?
Zorganizuj quiz lub konkurs z nagrodami. Zadawaj pytania dotyczące wartościowości reszt kwasowych i wzorów sumarycznych soli. To sprawdzony sposób na zaangażowanie uczniów.
Wykorzystaj gry edukacyjne online lub aplikacje mobilne. Istnieje wiele interaktywnych narzędzi, które pomogą uczniom w przyswojeniu wiedzy w sposób przyjemny i angażujący.
Zaproponuj uczniom, aby sami stworzyli modele cząsteczek soli. Mogą użyć plasteliny, klocków LEGO lub innych materiałów. To kreatywny sposób na zrozumienie struktury soli. Zbudowanie modelu to dobre ćwiczenie.
Przeprowadź prosty eksperyment. Na przykład, można pokazać, jak powstaje osad fosforanu(V) wapnia, mieszając roztwór chlorku wapnia z roztworem fosforanu(V) sodu. To pozwoli uczniom zobaczyć reakcję chemiczną w praktyce.
Możesz również omówić zastosowania soli kwasu fosforowego(V) w życiu codziennym. Są one używane w nawozach, detergentach, lekach i żywności. Pokazanie praktycznego zastosowania wiedzy zwiększa motywację uczniów.
Pamiętaj, że cierpliwość i kreatywność to klucz do sukcesu. Używaj różnych metod nauczania, aby dotrzeć do każdego ucznia. Powodzenia!