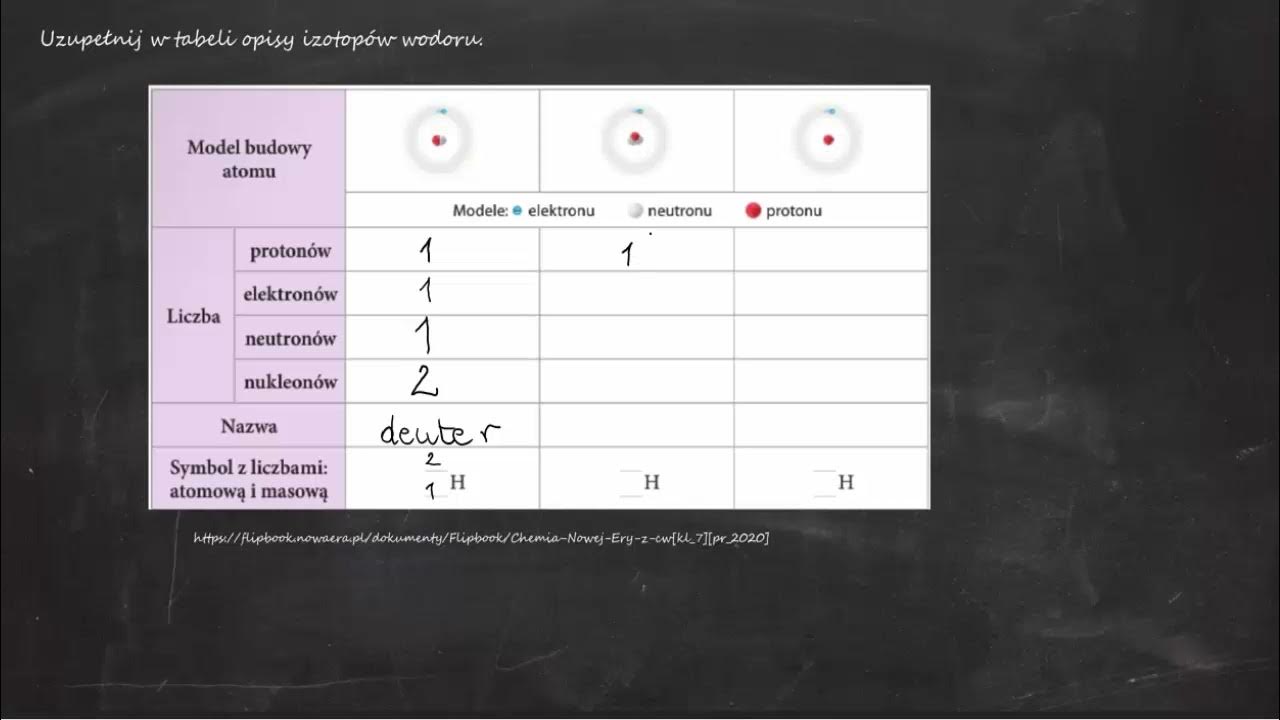
Witajcie! Dzisiaj zajmiemy się izotopami wodoru. Będziemy uzupełniać tabelę z ich opisami. To brzmi skomplikowanie? Spokojnie, rozłożymy to na czynniki pierwsze.
Czym są izotopy?
Wyobraź sobie, że masz klocki LEGO. Wszystkie są czerwone, ale niektóre mają dwa wypustki, a inne trzy. Wszystkie to "czerwone klocki", ale różnią się budową. Podobnie jest z izotopami.
Izotopy to atomy tego samego pierwiastka (czyli mają tę samą liczbę protonów), ale różnią się liczbą neutronów w jądrze. To jak te klocki LEGO – ten sam kolor, ale inna liczba wypustek.
Wodór i jego izotopy
Wodór, symbol H, to najprostszy pierwiastek. Ma tylko jeden proton i jeden elektron. Ale może mieć różne ilości neutronów. I to właśnie tworzy jego izotopy.
Prot
Najpopularniejszy izotop wodoru to prot (1H). To "zwykły" wodór. Ma 1 proton i 0 neutronów. Wyobraź sobie: jeden czerwony klocek, bez żadnych dodatkowych wypustek.
Ponad 99.9% wodoru w przyrodzie to właśnie prot. Jest lekki i powszechny. Używamy go na co dzień, chociażby w wodzie (H2O).
Deuter
Drugi izotop to deuter (2H lub D). Ma 1 proton i 1 neutron. Teraz mamy ten czerwony klocek z jedną dodatkową wypustką. Jest cięższy od protu.
Woda z deuterem zamiast protu nazywana jest ciężką wodą. Jest używana w niektórych reaktorach jądrowych. Pamiętasz elektrownię w Czarnobylu? Tam, zamiast zwykłej wody, wykorzystywano wodę, która zawierała domieszki deuteru.
Tryt
Trzeci izotop to tryt (3H lub T). Ma 1 proton i 2 neutrony. Nasz czerwony klocek ma teraz dwie dodatkowe wypustki! Tryt jest jeszcze cięższy od deuteru.
Tryt jest radioaktywny. Oznacza to, że jego jądro jest niestabilne i rozpada się, emitując promieniowanie. Używa się go w niektórych znakach ewakuacyjnych i w badaniach naukowych.
Uzupełniamy tabelę
Teraz możemy uzupełnić tabelę z opisami izotopów wodoru:
| Nazwa izotopu | Symbol | Liczba protonów | Liczba neutronów | Masa atomowa (u) | Stabilność |
|---|---|---|---|---|---|
| Prot | 1H | 1 | 0 | 1.0078 | Stabilny |
| Deuter | 2H (D) | 1 | 1 | 2.0141 | Stabilny |
| Tryt | 3H (T) | 1 | 2 | 3.0160 | Radioaktywny |
Spójrz na tabelę. Widzisz, jak zmienia się liczba neutronów i masa atomowa? To właśnie odróżnia izotopy od siebie.
Podsumowanie
Zapamiętaj: izotopy to atomy tego samego pierwiastka z różną liczbą neutronów. Wodór ma trzy główne izotopy: prot, deuter i tryt. Prot jest najlżejszy i najpowszechniejszy, deuter jest cięższy, a tryt jest radioaktywny.
Wyobraź sobie to jako różne wersje "klocka wodoru". Wszystkie mają ten sam "protonowy rdzeń", ale różnią się "neutronowymi dodatkami".
Mamy nadzieję, że teraz temat izotopów wodoru jest dla Ciebie bardziej zrozumiały! Pamiętaj, że nauka może być fascynująca, jeśli spojrzysz na nią z odpowiedniej perspektywy.