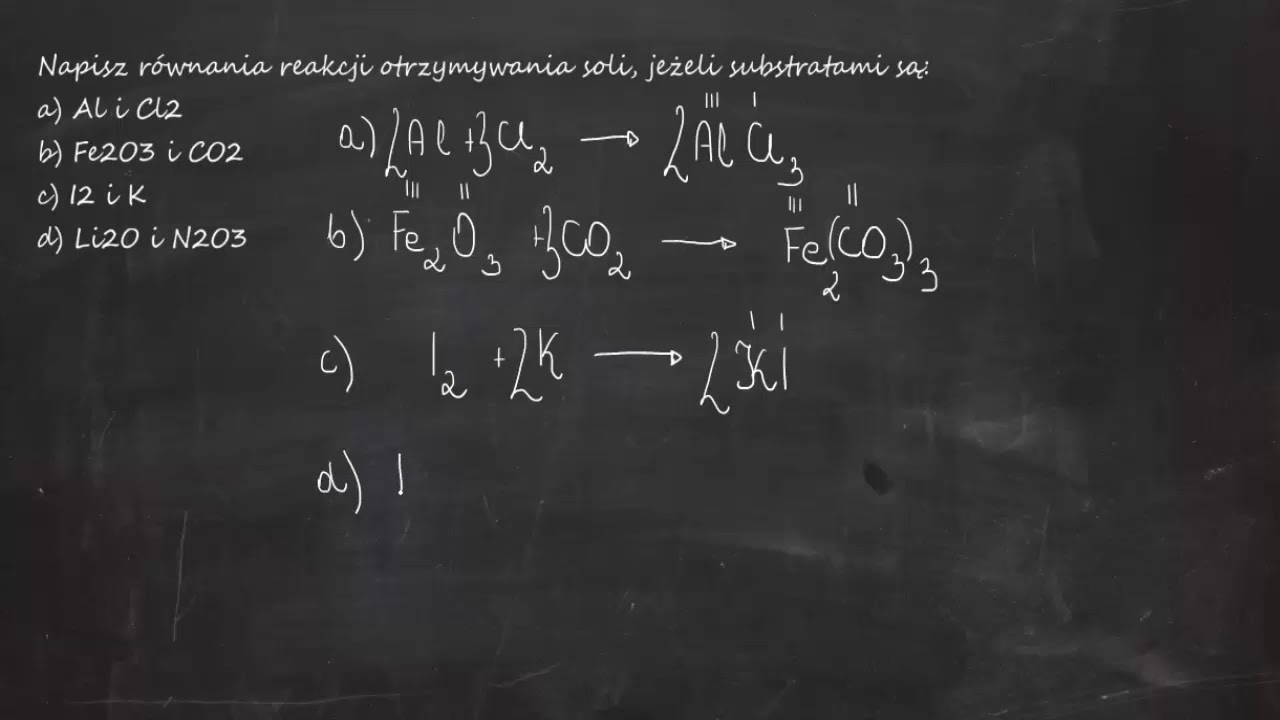Tlenki to związki chemiczne, które składają się z tlenu i innego pierwiastka. Są to jedne z najczęściej występujących związków w przyrodzie. Rozumienie, jak je otrzymywać, jest kluczowe w chemii. W tym artykule omówimy, jak uzupełniać równania reakcji otrzymywania tlenków.
Podstawowe Metody Otrzymywania Tlenków
Istnieje kilka głównych metod otrzymywania tlenków. Najpopularniejszą jest bezpośrednia reakcja pierwiastka z tlenem. Inne metody obejmują rozkład termiczny związków chemicznych i spalanie.
Reakcja Pierwiastka z Tlenem
Bezpośrednia reakcja pierwiastka z tlenem (O2) to częsty sposób na otrzymanie tlenku. W tej reakcji pierwiastek reaguje z tlenem, tworząc tlenek. Ważne jest, aby ustalić stechiometrię reakcji.
Przykład 1: Reakcja magnezu z tlenem. Magnez (Mg) reaguje z tlenem (O2), tworząc tlenek magnezu (MgO). Równanie reakcji wygląda następująco: 2Mg + O2 → 2MgO.
Przykład 2: Reakcja węgla z tlenem. Węgiel (C) może reagować z tlenem na dwa sposoby, w zależności od ilości tlenu. Przy niedostatku tlenu powstaje tlenek węgla(II) (CO): 2C + O2 → 2CO. Przy nadmiarze tlenu powstaje tlenek węgla(IV) (CO2): C + O2 → CO2.
Aby uzupełnić równanie reakcji, musimy znać symbole chemiczne reagentów i produktów. Następnie musimy zbilansować równanie, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. To zapewnia zgodność z prawem zachowania masy.
Rozkład Termiczny Związków
Niektóre związki chemiczne rozkładają się pod wpływem wysokiej temperatury, tworząc tlenki. Ta metoda jest szczególnie przydatna do otrzymywania tlenków metali przejściowych. Często wykorzystuje się do tego węglany, wodorotlenki i azotany.
Przykład 1: Rozkład węglanu wapnia. Węglan wapnia (CaCO3) rozkłada się pod wpływem ciepła, tworząc tlenek wapnia (CaO) i tlenek węgla(IV) (CO2). Równanie reakcji wygląda następująco: CaCO3 → CaO + CO2.
Przykład 2: Rozkład wodorotlenku miedzi(II). Wodorotlenek miedzi(II) (Cu(OH)2) rozkłada się pod wpływem ciepła, tworząc tlenek miedzi(II) (CuO) i wodę (H2O). Równanie reakcji wygląda następująco: Cu(OH)2 → CuO + H2O.
Ważne jest, aby znać produkty rozkładu danego związku. Często produkty rozkładu są przewidywalne, ale w niektórych przypadkach konieczna jest wiedza eksperymentalna. Zbilansowanie równania jest również kluczowe.
Spalanie
Spalanie to reakcja chemiczna, w której substancja reaguje z tlenem, wydzielając ciepło i światło. Wiele substancji organicznych, takich jak węglowodory, spala się, tworząc tlenek węgla(IV) i wodę. Spalanie może być również wykorzystywane do otrzymywania tlenków metali.
Przykład 1: Spalanie metanu. Metan (CH4) spala się w tlenie, tworząc tlenek węgla(IV) (CO2) i wodę (H2O). Równanie reakcji wygląda następująco: CH4 + 2O2 → CO2 + 2H2O.
Przykład 2: Spalanie siarki. Siarka (S) spala się w tlenie, tworząc tlenek siarki(IV) (SO2). Równanie reakcji wygląda następująco: S + O2 → SO2. W specyficznych warunkach może powstać również tlenek siarki(VI) (SO3): 2SO2 + O2 → 2SO3.
Przy uzupełnianiu równań spalania, ważna jest znajomość produktów spalania danej substancji. Równanie reakcji musi być zbilansowane, aby uwzględniało wszystkie atomy reagujących i powstających substancji. Czasem powstają niepełne produkty spalania, np. tlenek węgla(II) (CO), szczególnie przy niedostatku tlenu.
Uzupełnianie Równań Reakcji - Krok po Kroku
Uzupełnianie równań reakcji otrzymywania tlenków wymaga systematycznego podejścia. Najpierw trzeba zidentyfikować reagenty i produkty. Następnie trzeba zbilansować równanie.
Krok 1: Zidentyfikuj reagenty i produkty. Określ, które substancje reagują ze sobą, a które powstają w wyniku reakcji. Zapisz ich wzory chemiczne.
Krok 2: Napisz niekompletne równanie reakcji. Ułóż wzory chemiczne reagentów i produktów po odpowiednich stronach strzałki. Na przykład: Na + O2 → Na2O.
Krok 3: Zbilansuj równanie. Dostosuj współczynniki stechiometryczne przed wzorami chemicznymi, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania. W przykładzie z sodem i tlenem, zbilansowane równanie wygląda następująco: 4Na + O2 → 2Na2O.
Krok 4: Sprawdź, czy równanie jest zbilansowane. Upewnij się, że liczba atomów każdego pierwiastka jest taka sama po obu stronach równania. Jeśli nie, popraw współczynniki stechiometryczne.
Praktyczne Zastosowania
Znajomość reakcji otrzymywania tlenków ma wiele praktycznych zastosowań. Tlenki znajdują się w wielu materiałach, od ceramiki po elektronikę. Ich synteza jest kluczowa w wielu gałęziach przemysłu.
Przemysł ceramiczny: Tlenki, takie jak tlenek glinu (Al2O3) i tlenek krzemu (SiO2), są głównymi składnikami ceramiki. Proces ich syntezy i formowania determinuje właściwości gotowego produktu.
Elektronika: Tlenki metali, takie jak tlenek cynku (ZnO) i tlenek tytanu(IV) (TiO2), są stosowane w elektronice jako półprzewodniki i izolatory. Kontrola procesu ich otrzymywania jest kluczowa dla uzyskania odpowiednich właściwości elektrycznych.
Ochrona przed korozją: Tlenki metali, takie jak tlenek chromu(III) (Cr2O3), tworzą warstwy pasywne na powierzchni metali, chroniąc je przed korozją. Proces pasywacji jest wykorzystywany w wielu gałęziach przemysłu, aby zwiększyć trwałość i niezawodność produktów.
Uzupełnianie równań reakcji otrzymywania tlenków jest fundamentem zrozumienia procesów chemicznych. Daje to możliwość projektowania i optymalizacji procesów technologicznych. Pozwala to na wykorzystanie tlenków w różnorodnych dziedzinach.