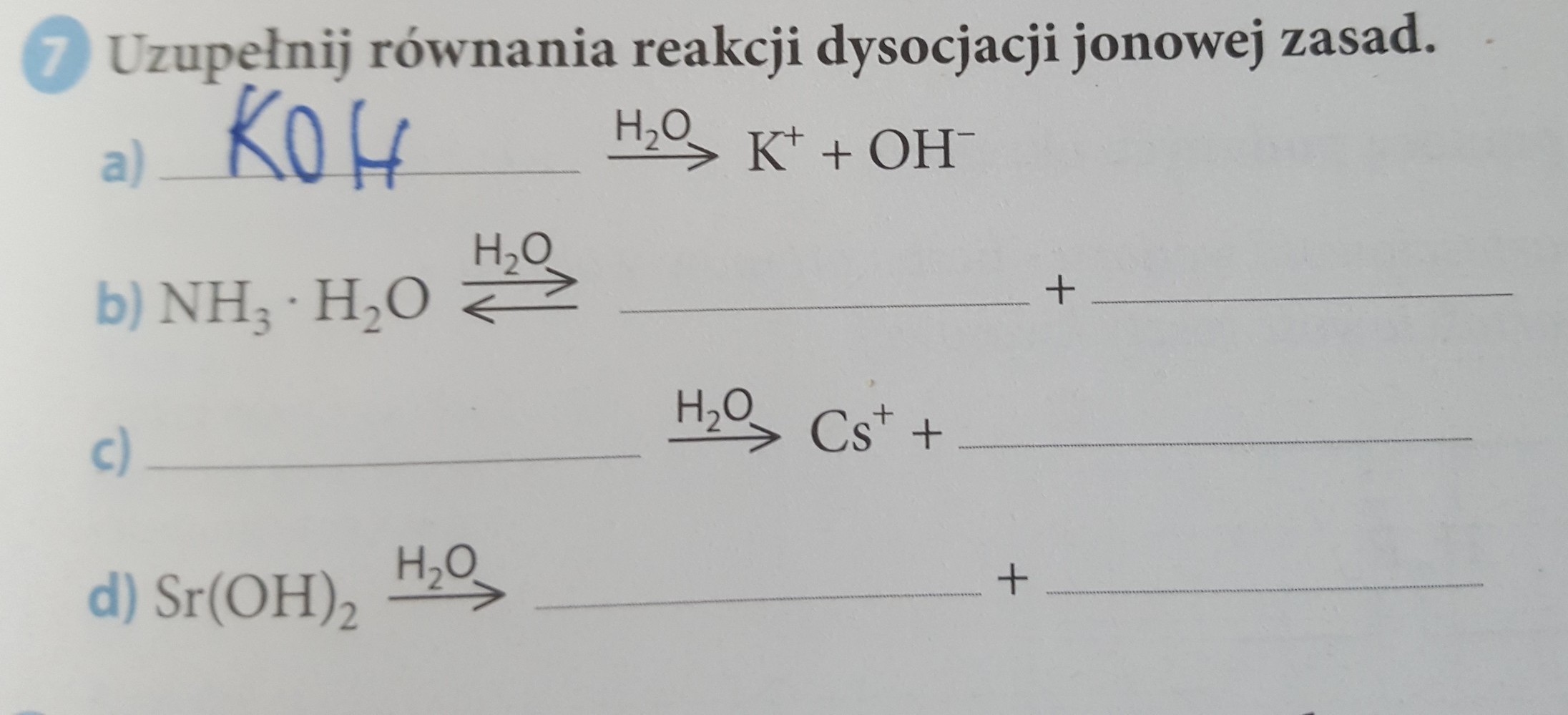
Dysocjacja jonowa zasad to rozpad związku chemicznego (zasady) na jony w roztworze wodnym.
Zasady to związki chemiczne, które reagują z kwasami, tworząc sole i wodę. Często zawierają grupę hydroksylową (OH-).
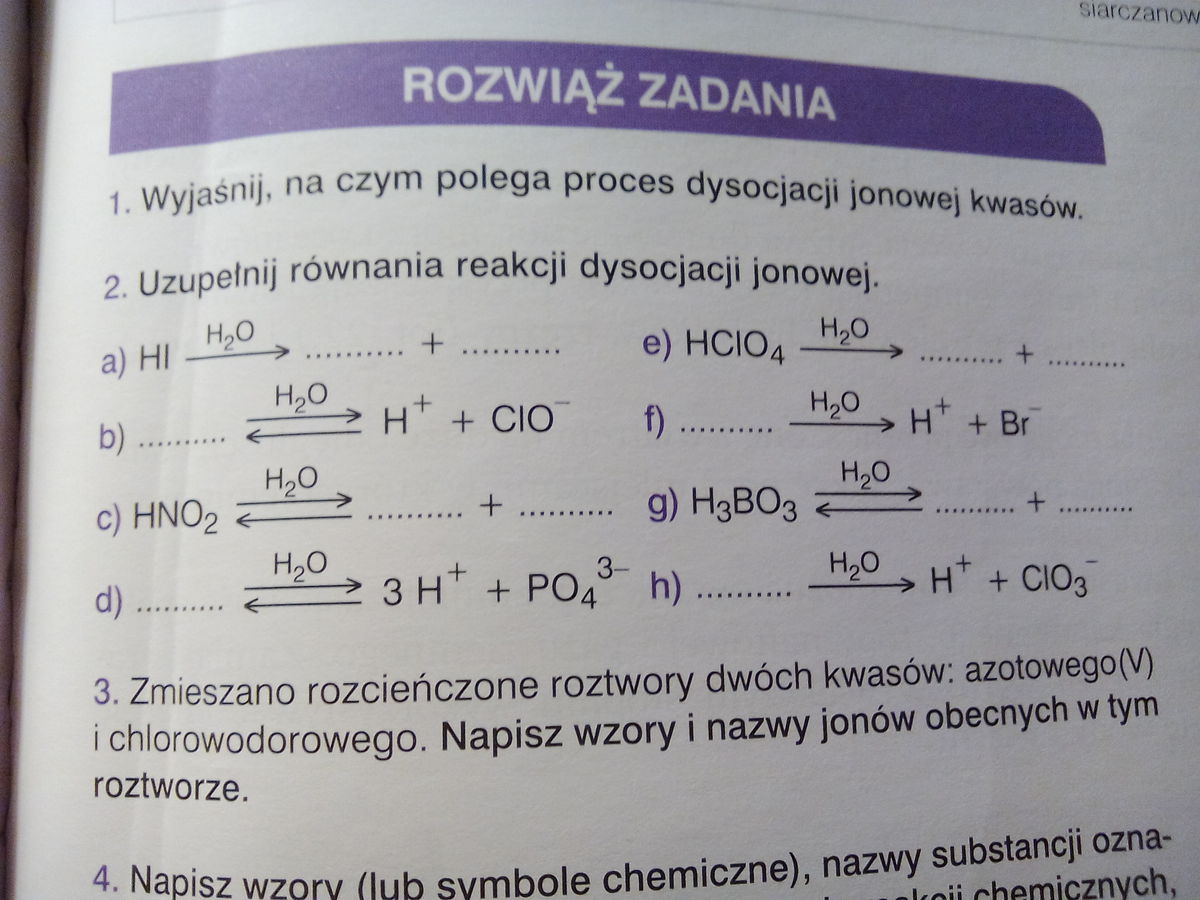
Zanim zaczniemy uzupełniać równania, zdefiniujmy kluczowe pojęcia.
Definicje
Dysocjacja to proces rozpadu związku na jony.
Jony to atomy lub grupy atomów posiadające ładunek elektryczny.
Kationy to jony o ładunku dodatnim (+).
Aniony to jony o ładunku ujemnym (-).
Zasada Arrheniusa: Zasada to substancja, która w roztworze wodnym zwiększa stężenie jonów hydroksylowych (OH-).
Jak pisać równania dysocjacji jonowej zasad?
Krok 1: Zidentyfikuj zasadę.
Krok 2: Określ jony, na które rozpada się zasada.
Krok 3: Zapisz równanie reakcji, uwzględniając ładunki jonów.
Krok 4: Zbilansuj równanie.
Przykłady
Przykład 1: Dysocjacja wodorotlenku sodu (NaOH)
Wodorotlenek sodu to silna zasada.
NaOH (s) → Na+ (aq) + OH- (aq)
NaOH rozpada się na kation sodu (Na+) i anion hydroksylowy (OH-).
Przykład 2: Dysocjacja wodorotlenku potasu (KOH)
Wodorotlenek potasu to również silna zasada.
KOH (s) → K+ (aq) + OH- (aq)
KOH rozpada się na kation potasu (K+) i anion hydroksylowy (OH-).
Przykład 3: Dysocjacja wodorotlenku wapnia (Ca(OH)2)
Wodorotlenek wapnia to zasada, ale słabiej rozpuszczalna w wodzie niż NaOH i KOH.
Ca(OH)2 (s) → Ca2+ (aq) + 2OH- (aq)
Ca(OH)2 rozpada się na kation wapnia (Ca2+) i dwa aniony hydroksylowe (2OH-). Ważne jest uwzględnienie współczynnika 2 przed OH-, aby zbilansować równanie.
Przykład 4: Dysocjacja wodorotlenku magnezu (Mg(OH)2)
Wodorotlenek magnezu to zasada o bardzo niskiej rozpuszczalności w wodzie.
Mg(OH)2 (s) → Mg2+ (aq) + 2OH- (aq)
Mg(OH)2 rozpada się na kation magnezu (Mg2+) i dwa aniony hydroksylowe (2OH-).
Przykład 5: Dysocjacja wodorotlenku glinu (Al(OH)3)
Wodorotlenek glinu praktycznie nie rozpuszcza się w wodzie.
Al(OH)3 (s) → Al3+ (aq) + 3OH- (aq)
Al(OH)3 rozpada się na kation glinu (Al3+) i trzy aniony hydroksylowe (3OH-).
Uzupełnianie Równań: Ćwiczenia
Spróbujmy teraz uzupełnić kilka równań dysocjacji jonowej zasad.
1. Wodorotlenek litu (LiOH):
LiOH (s) → ? + ?
Odpowiedź: LiOH (s) → Li+ (aq) + OH- (aq)
2. Wodorotlenek strontu (Sr(OH)2):
Sr(OH)2 (s) → ? + ?
Odpowiedź: Sr(OH)2 (s) → Sr2+ (aq) + 2OH- (aq)
3. Wodorotlenek żelaza(II) (Fe(OH)2):
Fe(OH)2 (s) → ? + ?
Odpowiedź: Fe(OH)2 (s) → Fe2+ (aq) + 2OH- (aq)
4. Wodorotlenek żelaza(III) (Fe(OH)3):
Fe(OH)3 (s) → ? + ?
Odpowiedź: Fe(OH)3 (s) → Fe3+ (aq) + 3OH- (aq)
Siła Zasad
Silne zasady dysocjują całkowicie w roztworze wodnym. Przykładami są NaOH, KOH, Ca(OH)2.
Słabe zasady dysocjują tylko częściowo w roztworze wodnym. Amoniak (NH3) jest przykładem słabej zasady. Amoniak reaguje z wodą, tworząc jony amonowe (NH4+) i jony hydroksylowe (OH-):
NH3 (aq) + H2O (l) ⇌ NH4+ (aq) + OH- (aq)
Zwróć uwagę na strzałkę w obie strony (⇌), która wskazuje, że reakcja jest odwracalna i nie zachodzi do końca.
Znaczenie dysocjacji jonowej zasad
Dysocjacja jonowa zasad ma ogromne znaczenie w wielu dziedzinach, takich jak:
- Chemia analityczna: Do określania stężenia zasad w roztworach.
- Biologia: W utrzymaniu odpowiedniego pH w komórkach i płynach ustrojowych.
- Przemysł: W produkcji mydeł, detergentów i innych produktów chemicznych.
- Ochrona środowiska: W neutralizacji kwaśnych deszczów i oczyszczaniu ścieków.
Zrozumienie dysocjacji jonowej zasad jest kluczowe dla dalszego studiowania chemii i pokrewnych dziedzin.