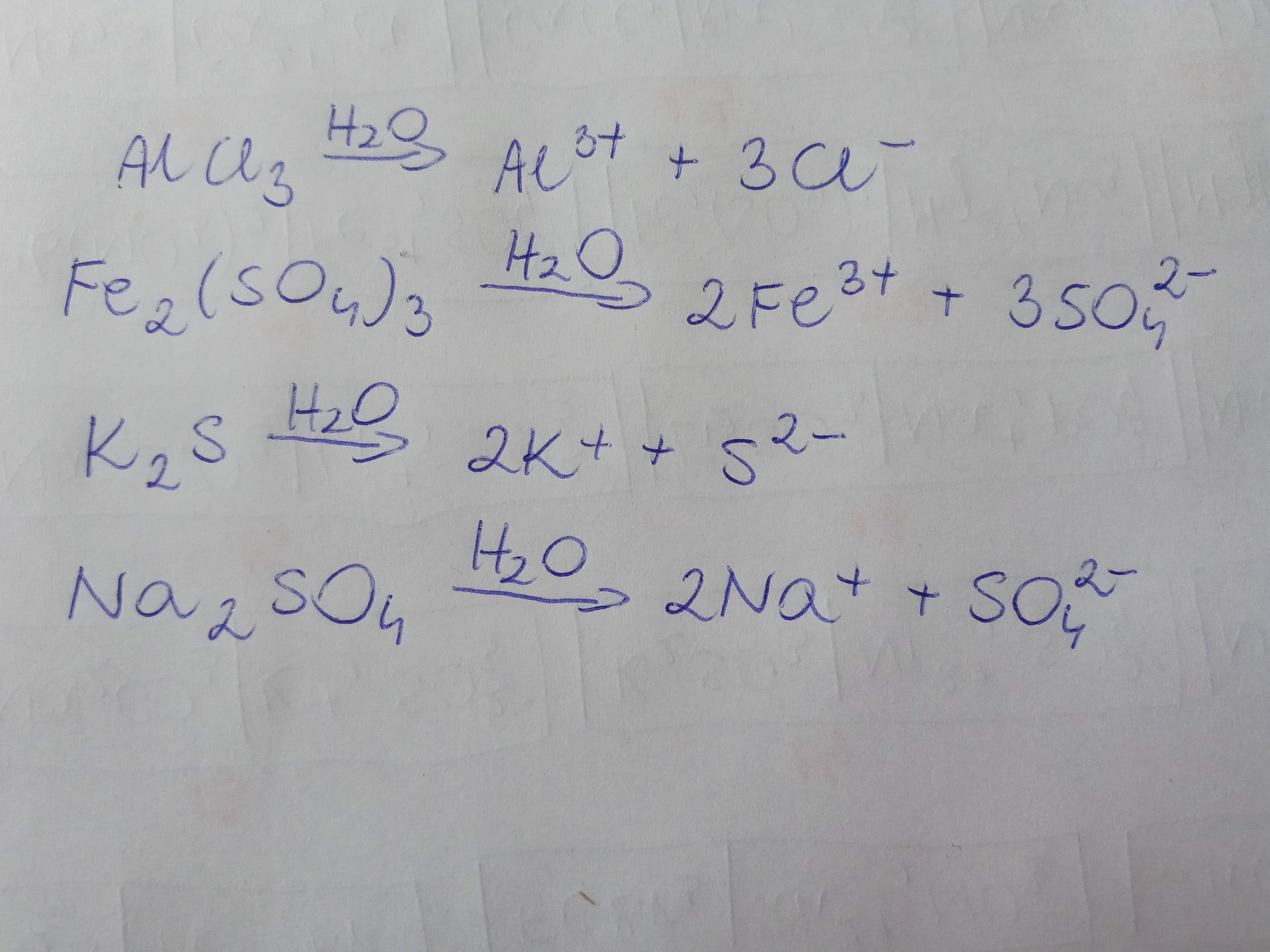Rozpocznijmy naszą podróż w świat dysocjacji jonowej! To fascynujący proces, który zachodzi, gdy sole rozpuszczają się w wodzie. Zrozumienie tego procesu jest kluczowe do pojęcia wielu reakcji chemicznych. W tym artykule skupimy się na tym, jak prawidłowo zapisywać równania reakcji dysocjacji jonowej soli.
Co to jest dysocjacja jonowa?
Dysocjacja jonowa to rozpad związku jonowego, takiego jak sól, na jony. Dzieje się to pod wpływem rozpuszczalnika polarnego, zazwyczaj wody. Cząsteczki wody otaczają jony soli i osłabiają siły elektrostatyczne, które je łączą. To z kolei prowadzi do uwolnienia jonów do roztworu.
Proces ten można porównać do rozdzielania klocków LEGO. Związek jonowy to zbudowana konstrukcja z klocków. Woda działa jak siła, która rozdziela te klocki (jony) od siebie.
Jak zapisywać równania dysocjacji jonowej soli?
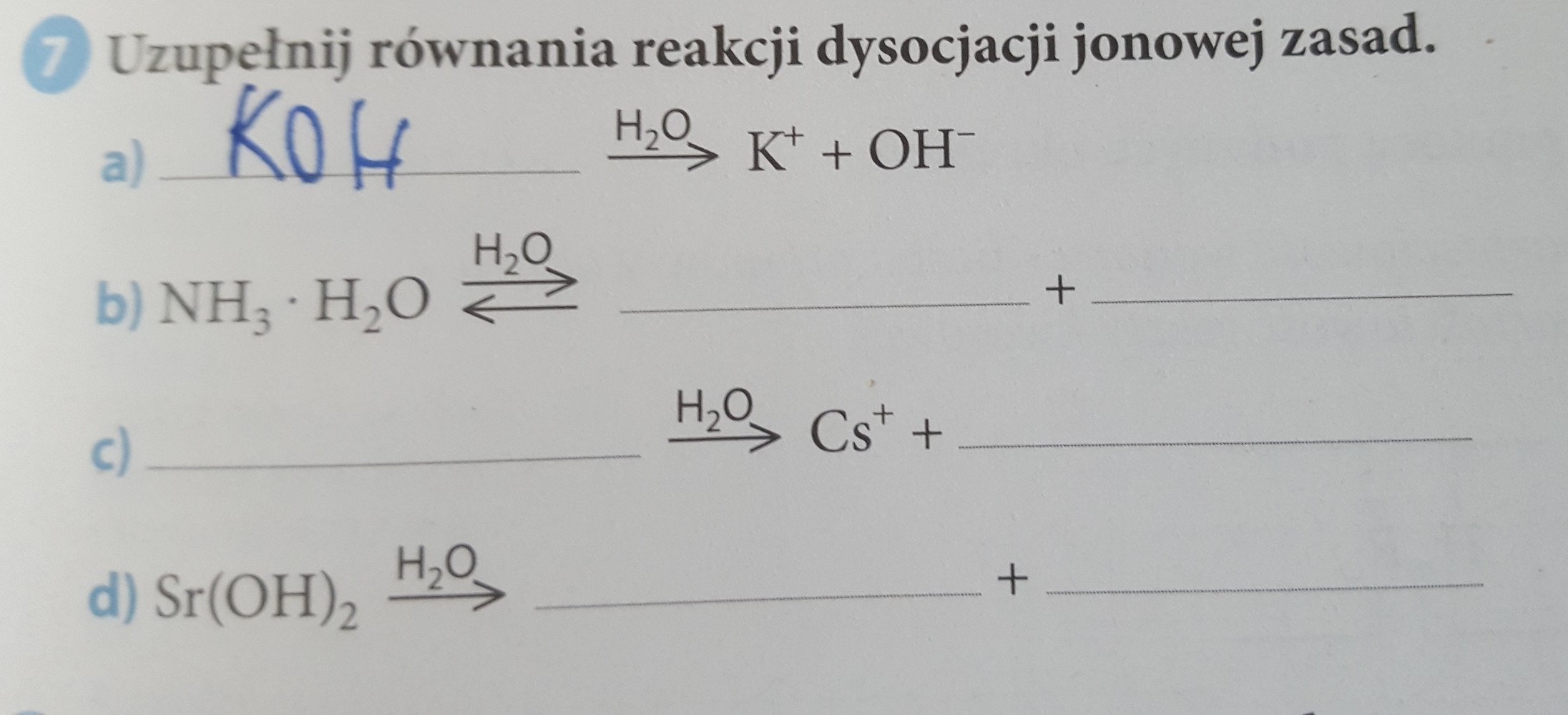
Zapisywanie równań dysocjacji jonowej soli jest proste, jeśli pamiętasz kilka kluczowych zasad. Przede wszystkim musisz znać wzór sumaryczny soli. Następnie, należy określić, jakie jony powstaną w wyniku dysocjacji. Ważne jest również, aby uwzględnić ładunki jonów oraz współczynniki stechiometryczne, aby równanie było zbilansowane.
Krok 1: Zapisz wzór sumaryczny soli.
To podstawa! Bez poprawnego wzoru soli nie zapiszesz poprawnego równania dysocjacji. Na przykład, jeśli mamy chlorek sodu, jego wzór to NaCl. Inne przykłady to siarczan potasu (K2SO4) czy azotan wapnia (Ca(NO3)2).
Krok 2: Określ jony powstające podczas dysocjacji.
Sole dysocjują na kationy (jony dodatnie) i aniony (jony ujemne). W przypadku NaCl, dysocjacja prowadzi do powstania kationu sodu (Na+) i anionu chlorkowego (Cl-). Pamiętaj o ładunkach jonów! To bardzo ważne!
Siarczan potasu (K2SO4) dysocjuje na dwa jony potasu (2K+) i jeden jon siarczanowy (SO42-). Azotan wapnia (Ca(NO3)2) dysocjuje na jeden jon wapnia (Ca2+) i dwa jony azotanowe (2NO3-).
Krok 3: Zbilansuj równanie.
Upewnij się, że liczba atomów każdego pierwiastka oraz ładunki po obu stronach równania są takie same. To jest zasada zachowania masy i ładunku. W przypadku NaCl równanie jest już zbilansowane: NaCl → Na+ + Cl-.
Jednak, dla K2SO4 potrzebujemy współczynnika 2 przed jonem potasu: K2SO4 → 2K+ + SO42-. Podobnie, dla Ca(NO3)2: Ca(NO3)2 → Ca2+ + 2NO3-.
Krok 4: Dodaj stan skupienia (aq).
Ponieważ dysocjacja jonowa zachodzi w roztworze wodnym, dodajemy oznaczenie (aq) (od łacińskiego aqua, czyli woda) do każdego jonu. Oznacza to, że jony są uwodnione, czyli otoczone przez cząsteczki wody.
Pełne równania dysocjacji wyglądają więc następująco: NaCl(s) → Na+(aq) + Cl-(aq), K2SO4(s) → 2K+(aq) + SO42-(aq), Ca(NO3)2(s) → Ca2+(aq) + 2NO3-(aq). Zauważ, że sól w stanie stałym (s) przechodzi w jony w roztworze wodnym (aq).
Przykłady dysocjacji jonowej soli
Zobaczmy więcej przykładów, aby utrwalić wiedzę.
Bromek potasu (KBr): KBr(s) → K+(aq) + Br-(aq). Jeden jon potasu i jeden jon bromkowy.
Siarczan glinu (Al2(SO4)3): Al2(SO4)3(s) → 2Al3+(aq) + 3SO42-(aq). Dwa jony glinu i trzy jony siarczanowe.
Fosforan sodu (Na3PO4): Na3PO4(s) → 3Na+(aq) + PO43-(aq). Trzy jony sodu i jeden jon fosforanowy.
Praktyczne zastosowania dysocjacji jonowej
Zrozumienie dysocjacji jonowej jest ważne w wielu dziedzinach nauki i technologii. Na przykład, w chemii analitycznej, dysocjacja soli jest kluczowa do określania stężenia jonów w roztworze. W biologii, proces ten odgrywa ważną rolę w transporcie elektrolitów w organizmie.
W przemyśle, dysocjacja jonowa jest wykorzystywana w procesach elektrolizy, w produkcji chemikaliów i w uzdatnianiu wody. Na przykład, elektroliza roztworu chlorku sodu prowadzi do produkcji chloru, wodoru i wodorotlenku sodu. Z kolei dodawanie soli do wody basenowej ułatwia dezynfekcję.
Pamiętaj, że zrozumienie podstawowych zasad chemii, takich jak dysocjacja jonowa, otwiera drzwi do głębszego zrozumienia świata wokół nas. Ćwicz zapisywanie równań, a szybko staniesz się ekspertem w tej dziedzinie! Powodzenia!