Hej! Dziś zajmiemy się dysocjacją jonową kwasów. Będzie prosto i z obrazkami w głowie. Gotowi?
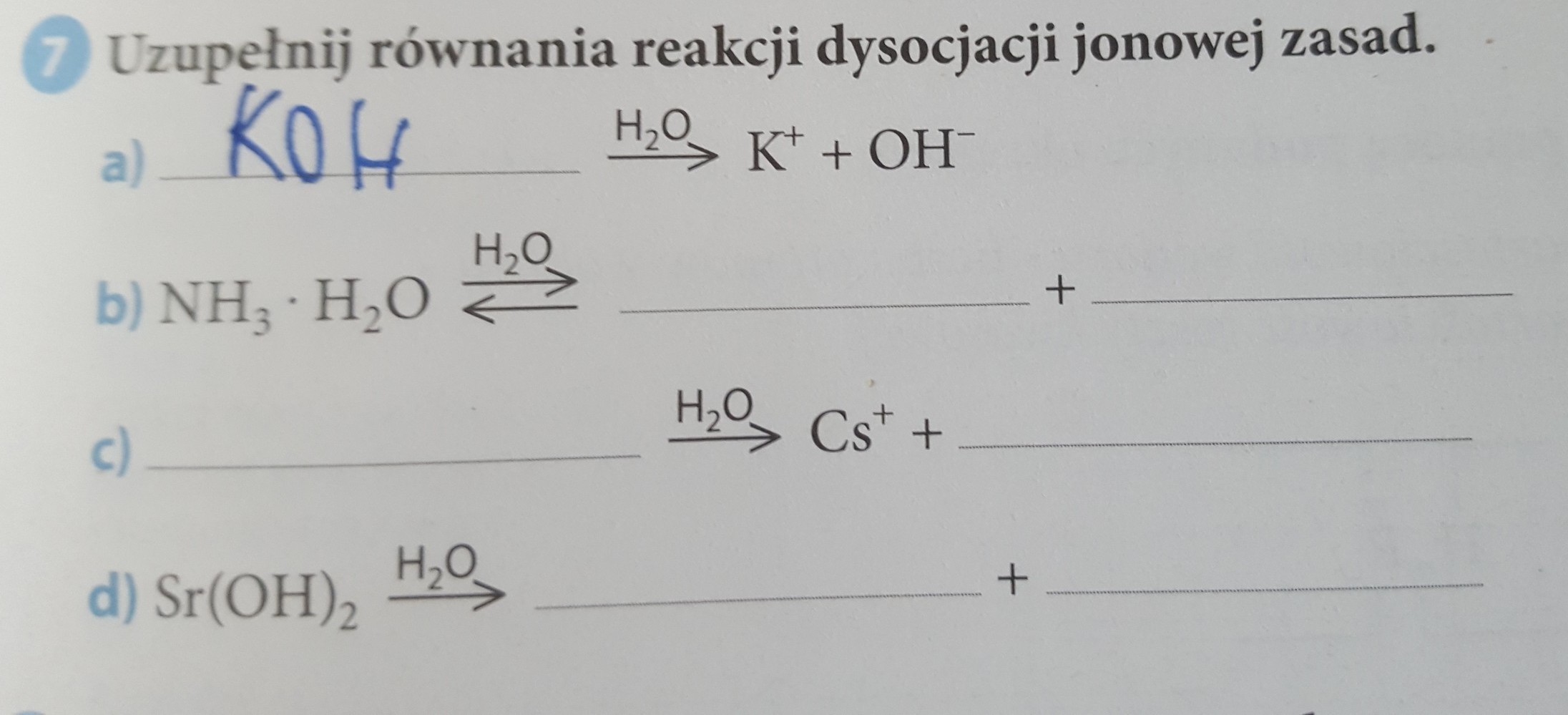
Czym jest Dysocjacja Jonowa?
Wyobraź sobie klocki LEGO. Połączone, tworzą kwas. Dysocjacja to jak rozdzielenie tych klocków.
Ale zamiast klocków mamy jony. Naładowane elektrycznie cząstki. Dodatnie i ujemne.
Kwas wrzucony do wody rozpada się na te jony. To właśnie dysocjacja.
Kwas jak Dom
Myśl o kwasie jako o domu. Atom wodoru (H) to syn, a reszta kwasowa to mama.
Woda to rozwód! Syn (H+) odchodzi od mamy (reszty kwasowej).
H+ to jon wodorowy. Nadaje kwasom ich kwaśny smak i właściwości.
Reszta kwasowa staje się jonem ujemnym. Mama zostaje sama, ale naładowana ujemnie.
Przykłady Dysocjacji
Zajmijmy się konkretami. Kwas solny (HCl) to popularny kwas.
HCl → H+ + Cl-
Widzisz? HCl rozpada się na jon wodorowy (H+) i jon chlorkowy (Cl-).
Wyobraź sobie: HCl to dwie kropelki, jedna zielona (H) i jedna żółta (Cl) połączone. W wodzie rozdzielają się na zieloną kropelkę z plusem (H+) i żółtą kropelkę z minusem (Cl-).
Kolejny przykład: Kwas siarkowy (H2SO4). To mocniejszy zawodnik.
H2SO4 → 2H+ + SO4 2-
Tu mamy dwa jony wodorowe (2H+) i jon siarczanowy (SO4 2-).
Tutaj mamy dwie zielone kropelki (H) i jedną dużą fioletową (SO4). W wodzie, dwie zielone odskakują z plusem (2H+), a fioletowa zostaje z dwoma minusami (SO4 2-).
Zauważ, że liczba atomów musi się zgadzać po obu stronach równania.
Stopień Dysocjacji
Nie wszystkie kwasy dysocjują w 100%. Niektóre tylko częściowo.
Wyobraź sobie, że masz 10 domów z synem i mamą. Nie we wszystkich domach nastąpi rozwód.
Stopień dysocjacji to procent domów, w których doszło do rozpadu na jony.
Kwasy, które dysocjują prawie całkowicie, to mocne kwasy. Np. HCl, H2SO4, HNO3.
Kwasy, które dysocjują słabo, to słabe kwasy. Np. CH3COOH (kwas octowy).
Kwas octowy to dom, gdzie syn często zostaje z mamą.
Uzupełnianie Równań
Teraz spróbujemy uzupełnić równania dysocjacji.
Przykład 1: HNO3 → ? + ?
Myślimy: HNO3 to kwas azotowy. Rozpada się na jon wodorowy i resztę kwasową.
HNO3 → H+ + NO3-
W HNO3 odrywamy zieloną kropelkę (H) z plusem (H+) i zostaje nam NO3 z minusem (NO3-).
Przykład 2: H3PO4 → ? + ?
To kwas fosforowy. Może oddać aż trzy jony wodorowe.
H3PO4 → 3H+ + PO4 3-
Tu odrywamy trzy zielone kropelki (3H+) i zostaje nam PO4 z trzema minusami (PO4 3-).
Pamiętaj o Ładunkach!
Suma ładunków po obu stronach równania musi być taka sama. Zawsze.
Jeśli po lewej stronie jest 0 (cząsteczka obojętna), to po prawej suma ładunków też musi wynosić 0.
HCl (0) → H+ (+1) + Cl- (-1). +1 + (-1) = 0
H2SO4 (0) → 2H+ (+2) + SO4 2- (-2). +2 + (-2) = 0
Sprawdzaj, czy wszystko się zgadza!
Dysocjacja w Praktyce
Dysocjacja jonowa jest ważna w wielu procesach.
W akumulatorach samochodowych. Tam kwasy dysocjują, tworząc jony, które przewodzą prąd.
W trawieniu w żołądku. Kwas solny (HCl) pomaga rozkładać pokarm.
W analizie chemicznej. Dzięki dysocjacji możemy wykrywać obecność różnych jonów w roztworach.
Podsumowanie
Dysocjacja to rozpad kwasu na jony w wodzie.
Jon wodorowy (H+) nadaje kwasom ich właściwości.
Stopień dysocjacji określa, jak bardzo kwas dysocjuje.
Pamiętaj o uzupełnianiu równań i sprawdzaniu ładunków.
Teraz jesteś ekspertem od dysocjacji! Powodzenia!