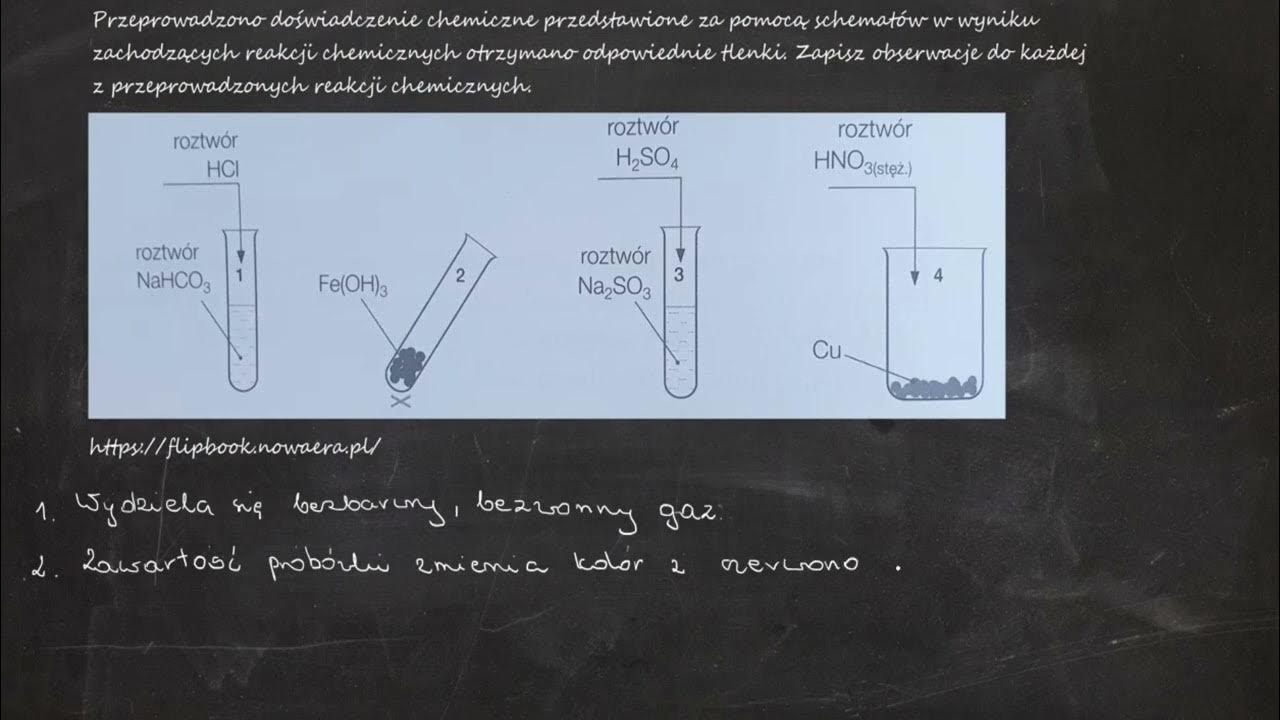
Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Skupmy się na wiązaniu chemicznym w cząsteczce chlorowodoru (HCl). To doskonały przykład do zrozumienia polarności wiązań.
Charakterystyka Chlorowodoru (HCl)
Chlorowodór to związek chemiczny składający się z jednego atomu wodoru (H) i jednego atomu chloru (Cl).
W temperaturze pokojowej występuje w postaci bezbarwnego gazu o ostrym zapachu.
Kiedy chlorowodór rozpuszcza się w wodzie, tworzy kwas solny (HCl(aq)), silny kwas.
Wiązanie Kovalentne Spolaryzowane
Wiązanie między atomami wodoru i chloru w HCl to wiązanie kowalencyjne spolaryzowane.
Co to oznacza? To wiązanie, w którym elektrony nie są dzielone równo między atomami.
Elektroujemność
Kluczowym pojęciem jest elektroujemność.
Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu chemicznym.
Chlor jest bardziej elektroujemny niż wodór. Oznacza to, że chlor "ciągnie" elektrony wiążące mocniej do siebie.
Rozkład Gęstości Elektronowej
Z powodu różnicy elektroujemności, gęstość elektronowa jest przesunięta w kierunku atomu chloru.
To powoduje, że atom chloru uzyskuje częściowy ładunek ujemny (δ-), a atom wodoru uzyskuje częściowy ładunek dodatni (δ+).
Używamy symboli δ+ i δ- aby oznaczyć te częściowe ładunki. Nie są to pełne ładunki jak w jonach.
Dipolowy Moment Wiązania
Powstanie częściowych ładunków prowadzi do powstania dipolowego momentu wiązania.
Dipol to cząsteczka, w której występuje rozdzielenie ładunków.
Dipolowy moment wiązania jest miarą polarności wiązania. Im większa różnica elektroujemności, tym większy moment dipolowy.
Reprezentacja Dipolu
Dipol możemy przedstawić strzałką, skierowaną od atomu z ładunkiem dodatnim (δ+) do atomu z ładunkiem ujemnym (δ-).
W przypadku HCl strzałka będzie skierowana od H do Cl.
Konsekwencje Polarności Wiązania
Polarność wiązania w HCl ma wpływ na właściwości fizyczne i chemiczne tego związku.
Na przykład, cząsteczki HCl oddziałują ze sobą poprzez oddziaływania dipol-dipol.
Oddziaływania dipol-dipol są słabsze niż wiązania wodorowe, ale silniejsze niż siły van der Waalsa.
Rozpuszczalność w Wodzie
Polarność HCl sprawia, że jest on dobrze rozpuszczalny w wodzie.
Cząsteczki wody (H2O) są również polarne, co pozwala na tworzenie się oddziaływań między cząsteczkami HCl i H2O.
Atom wodoru z częściowym ładunkiem dodatnim (δ+) w HCl jest przyciągany do atomu tlenu z częściowym ładunkiem ujemnym (δ-) w H2O.
Atom chloru z częściowym ładunkiem ujemnym (δ-) w HCl jest przyciągany do atomów wodoru z częściowym ładunkiem dodatnim (δ+) w H2O.
To prowadzi do hydratacji jonów, które powstają, gdy HCl rozpuszcza się w wodzie.
Dysocjacja w Wodzie
W roztworze wodnym HCl ulega dysocjacji.
Dysocjacja to rozpad związku na jony.
HCl dysocjuje na jon wodorowy (H+) i jon chlorkowy (Cl-).
To właśnie obecność jonów wodorowych (H+) powoduje, że roztwór HCl ma charakter kwasowy.
Równanie Dysocjacji
Równanie dysocjacji HCl w wodzie wygląda następująco:
HCl(g) + H2O(l) → H3O+(aq) + Cl-(aq)
Jon H+ łączy się z cząsteczką wody, tworząc jon hydroniowy (H3O+).
Podsumowanie
Pamiętaj!
- Wiązanie w HCl jest kowalencyjne spolaryzowane.
- Chlor jest bardziej elektroujemny niż wodór.
- Powstaje dipolowy moment wiązania.
- HCl jest dobrze rozpuszczalny w wodzie i ulega dysocjacji.
Zrozumienie tych pojęć pomoże Ci świetnie poradzić sobie na egzaminie!
Powodzenia!