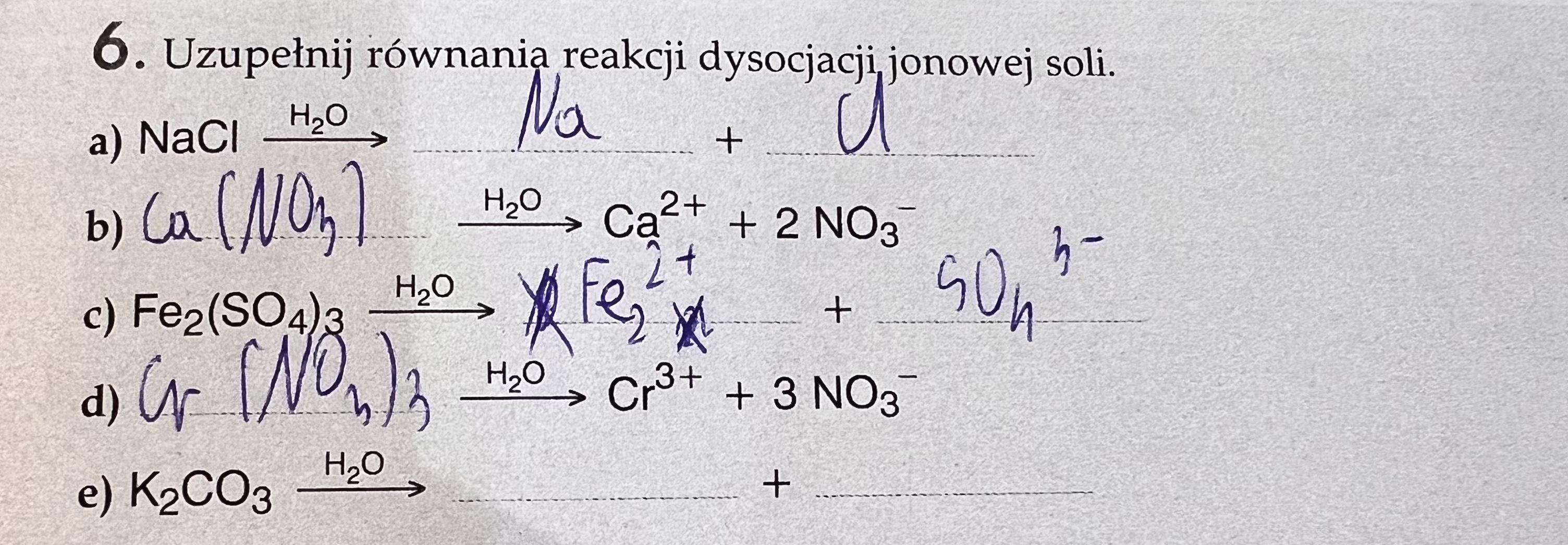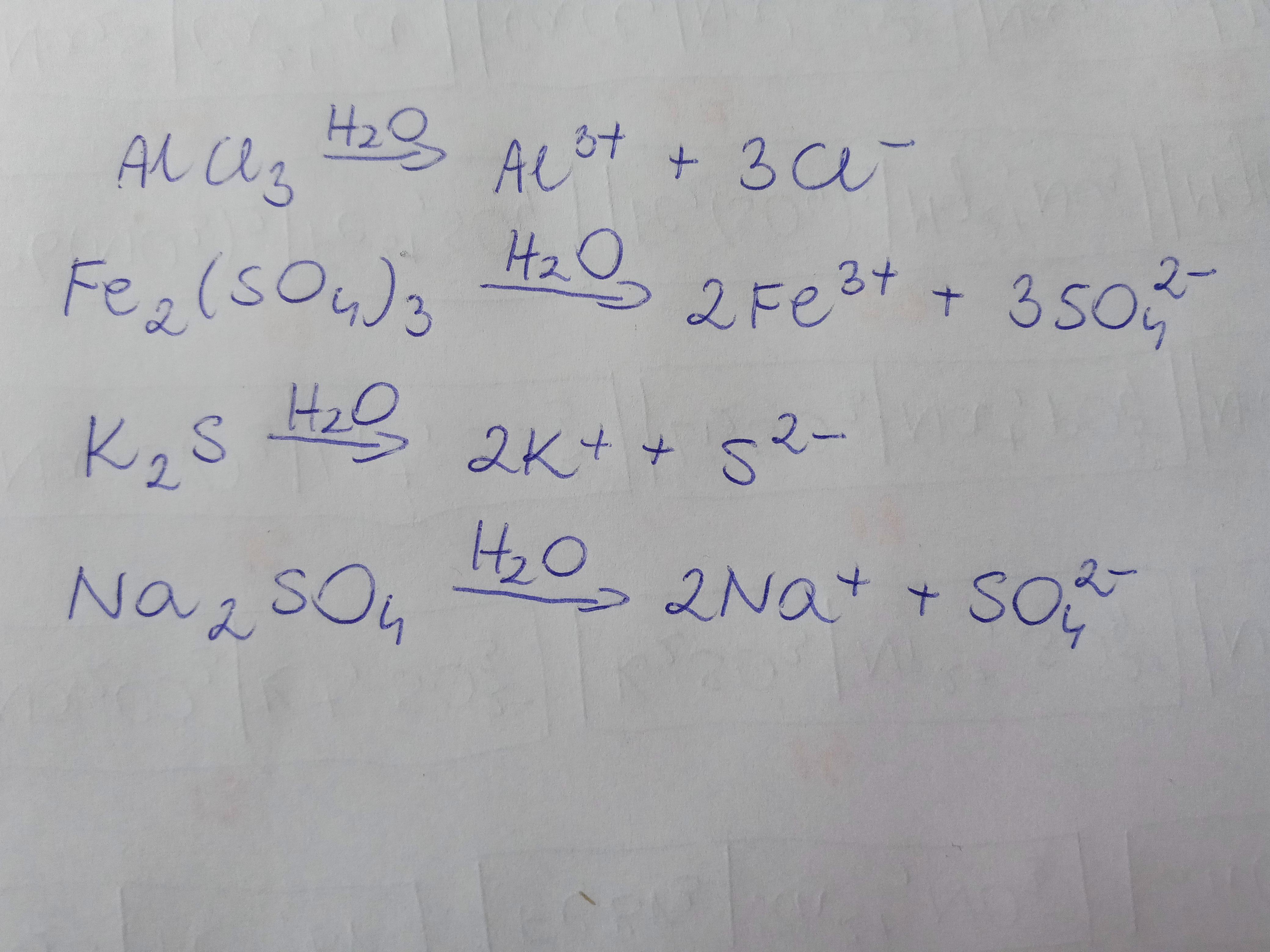Cześć! Przygotowujesz się do sprawdzianu z dysocjacji jonowej soli? Świetnie trafiłeś! Razem to ogarniemy. Pokażę Ci, jak uzupełniać i uzgadniać równania reakcji. Bez stresu, krok po kroku.
Co to jest dysocjacja jonowa?
To rozpad związku chemicznego na jony. Dzieje się to pod wpływem rozpuszczalnika, najczęściej wody.
Dysocjacja jonowa dotyczy związków jonowych. Na przykład soli, mocnych kwasów i zasad.
Sole rozpuszczone w wodzie rozpadają się na kationy (jony dodatnie) i aniony (jony ujemne).
Jak pisać równania dysocjacji?
Zacznijmy od prostego przykładu. Chlorek sodu (NaCl).
NaCl (s) --(H2O)--> Na+ (aq) + Cl- (aq)
Co tu widzimy?
- NaCl (s): Chlorek sodu w stanie stałym.
- H2O: Woda, która powoduje dysocjację. Zapisujemy nad strzałką.
- Na+ (aq): Kation sodu w roztworze wodnym.
- Cl- (aq): Anion chlorkowy w roztworze wodnym.
Zwróć uwagę na stany skupienia. (s) - stały, (aq) - roztwór wodny (aqua).
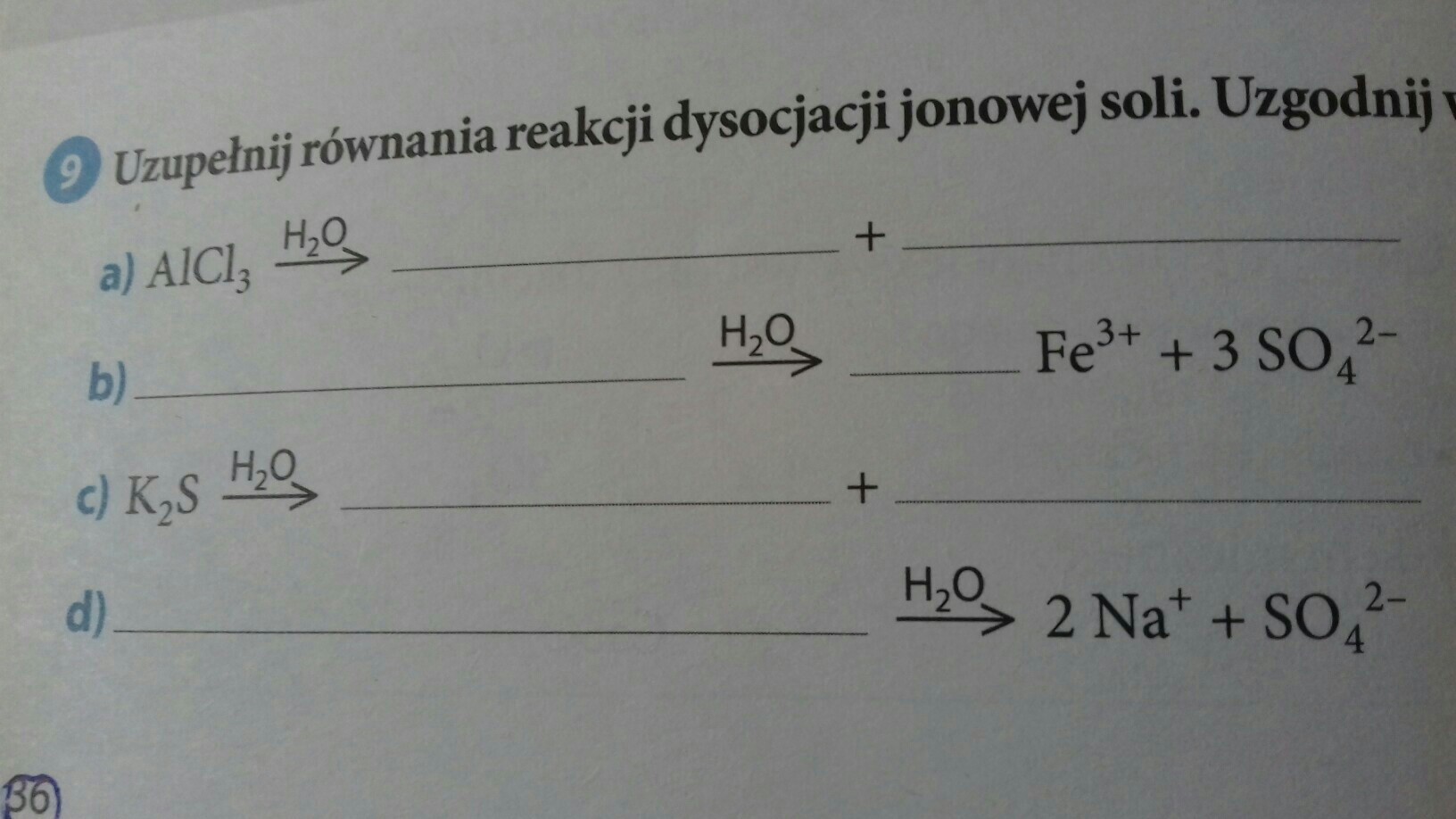
Uzupełnianie równań
Dostajesz niekompletne równanie. Twoim zadaniem jest dopisać brakujące jony i ich ładunki.
Przykład:
K2SO4 (s) --(H2O)--> ...
Musisz ustalić, jakie jony powstaną.
K2SO4 to siarczan(VI) potasu. Rozpada się na kationy potasu (K+) i aniony siarczanowe(VI) (SO42-).
Uzupełnione równanie:
K2SO4 (s) --(H2O)--> 2K+ (aq) + SO42- (aq)
Dlaczego 2K+? Bo w cząsteczce K2SO4 są dwa atomy potasu.
Uzgadnianie równań
Chodzi o to, żeby liczba atomów każdego pierwiastka i ładunek po obu stronach równania były takie same.
Spójrzmy jeszcze raz na K2SO4.
K2SO4 (s) --(H2O)--> 2K+ (aq) + SO42- (aq)
Policzmy atomy:
- Potas (K): 2 po lewej, 2 po prawej.
- Siarka (S): 1 po lewej, 1 po prawej.
- Tlen (O): 4 po lewej, 4 po prawej.
Policzmy ładunki:
- Po lewej stronie: 0 (cząsteczka obojętna).
- Po prawej stronie: 2 * (+1) + (-2) = 0.
Równanie jest uzgodnione!
Trudniejsze przykłady
Al2(SO4)3 (s) --(H2O)--> ?
To siarczan(VI) glinu. Rozpada się na kationy glinu (Al3+) i aniony siarczanowe(VI) (SO42-).
Ustalmy współczynniki.
Al2(SO4)3 (s) --(H2O)--> 2Al3+ (aq) + 3SO42- (aq)
Sprawdźmy:
- Aluminium (Al): 2 po lewej, 2 po prawej.
- Siarka (S): 3 po lewej, 3 po prawej.
- Tlen (O): 12 po lewej, 12 po prawej.
Ładunki:
- Po lewej: 0
- Po prawej: 2 * (+3) + 3 * (-2) = 6 - 6 = 0
Uzgdonione!
Kilka wskazówek
- Zawsze patrz na wzór sumaryczny soli.
- Ustal, jakie jony się tworzą.
- Pamiętaj o wartościowości jonów.
- Uzgadniaj liczbę atomów i ładunków.
- Ćwicz! Im więcej przykładów zrobisz, tym lepiej zrozumiesz.
Przykłady do samodzielnego rozwiązania
Spróbuj uzupełnić i uzgodnić poniższe równania:
- CaCl2 (s) --(H2O)--> ?
- FeCl3 (s) --(H2O)--> ?
- CuSO4 (s) --(H2O)--> ?
Podsumowanie
Dysocjacja jonowa to rozpad soli na jony w wodzie. Musisz umieć uzupełniać i uzgadniać równania tych reakcji. Pamiętaj o jonach, ładunkach i współczynnikach stechiometrycznych. Powodzenia na sprawdzianie!