Hej! Dziś zajmiemy się ustalaniem wzoru sumarycznego kwasu.
To brzmi skomplikowanie, ale spokojnie, rozłożymy to na czynniki pierwsze. Będzie obrazkowo i prosto.
Krok 1: Co to w ogóle jest wzór sumaryczny?
Pomyśl o tym jak o przepisie na ciasto. Wzór sumaryczny to "przepis" na cząsteczkę kwasu.
Mówi nam, jakie atomy i w jakiej ilości składają się na tę cząsteczkę.
Na przykład, woda ma wzór H2O. Dwa atomy wodoru (H) i jeden atom tlenu (O).
To proste, prawda? Wzór sumaryczny pokazuje nam "składniki" i ich liczbę.
Krok 2: Czym charakteryzują się kwasy?
Kwasy... kojarzą się z cytryną (kwaśna) lub octem. W chemii to coś więcej.
Kwasy to związki, które w roztworach wodnych uwalniają jony wodorowe (H+).
Wyobraź sobie, że kwas to taka "fabryka" jonów wodorowych.
Dlatego, w wzorze kwasu "na początku" często (ale nie zawsze!) widzimy wodór (H).
Na przykład, kwas solny: HCl. Zaczyna się od H, prawda?
Krok 3: Wiemy, że mamy kwas... co dalej?
Dostajemy informację: "To jest kwas!". Super. Ale jaki?
Musimy wiedzieć coś więcej. Na przykład, jakie inne atomy znajdują się w tym kwasie.
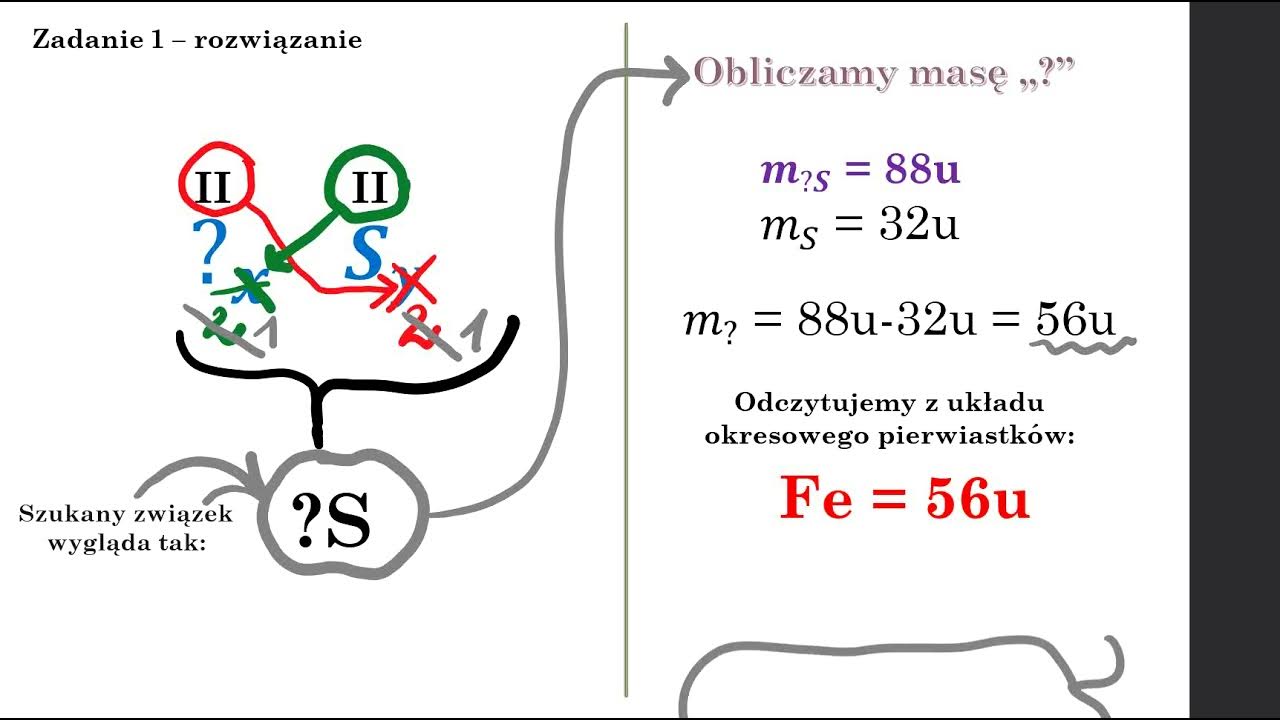
Często dostaniemy informację, że kwas zawiera np. siarkę (S) i tlen (O).
Albo, że jest to kwas, który powstaje po rozpuszczeniu pewnego gazu w wodzie.
Krok 4: Kwas beztlenowy czy tlenowy?
To bardzo ważne rozróżnienie.
Kwasy beztlenowe: Zawierają wodór (H) i jeden inny pierwiastek (np. chlor - Cl, siarka - S).
Przykłady: HCl (kwas solny), H2S (kwas siarkowodorowy).
Kwasy tlenowe: Zawierają wodór (H), tlen (O) i jeszcze jeden pierwiastek centralny (np. azot - N, siarka - S, fosfor - P).
Przykłady: H2SO4 (kwas siarkowy(VI)), HNO3 (kwas azotowy(V)).
Tlen "mówi" nam, że mamy do czynienia z kwasem tlenowym.
Krok 5: Ustalanie wzoru krok po kroku (dla kwasu tlenowego)
Załóżmy, że wiemy, iż mamy kwas, który zawiera wodór (H), tlen (O) i azot (N).
Wiemy też, że azot tworzy kwas azotowy(V).
Oznacza to, że azot ma wartościowość V (5).
Tlen ma wartościowość II (2), a wodór I (1).
Teraz użyjemy "krzyżówki wartościowości". Wyobraź sobie, że wartościowości "zamieniają się miejscami".
Najpierw piszemy wzór sumaryczny "na sucho": HNO. Bez liczb.
Teraz zastanawiamy się ile atomów tlenu musi być, żeby "zrównoważyć" wartościowość azotu.
Azot ma wartościowość V. Wodór ma wartościowość I. Razem mają VI (1+5=6).
Tlen ma wartościowość II. Ile atomów tlenu potrzebujemy, żeby mieć wartościowość VI? Trzy (3*2=6).
Więc wzór sumaryczny to: HNO3. Kwas azotowy(V).
Inny przykład: Kwas siarkowy(VI). Siarka (S), tlen (O), wodór (H).
Siarka ma wartościowość VI. Wodór ma wartościowość I. Tlen ma wartościowość II.
Wzór "na sucho": HSO
Siarka ma wartościowość VI, każdy wodór ma wartościowość I. I potrzebujemy 2 wodory, więc wartościowość wodoru to 2. Suma to 6 + 2 = 8
Dwa atomy wodoru, ponieważ tlenu będzie więcej niż jednego. Wartościowość siarki to 6, a wodoru 1. Potrzebujemy dwóch atomów wodoru (H2) aby zrównoważyć dwa atomy tlenu (O4 - 4 * 2 = 8). Stąd: H2SO4
Krok 6: Ustalanie wzoru krok po kroku (dla kwasu beztlenowego)
Tu jest prościej! Mamy wodór (H) i jeden inny pierwiastek.
Na przykład, kwas siarkowodorowy. Siarka (S) ma wartościowość II.
Wodór (H) ma wartościowość I.
Potrzebujemy dwóch atomów wodoru, żeby "zrównoważyć" siarkę.
Więc wzór to: H2S.
Kwas fluorowodorowy. Fluor (F) ma wartościowość I.
Wodór (H) ma wartościowość I.
Więc wzór to: HF.
Podsumowanie
Ustalanie wzoru sumarycznego kwasu wymaga kilku kroków:
- Rozpoznania, że to kwas.
- Określenia, jakie atomy zawiera (wodór, tlen, inne pierwiastki).
- Ustalenia wartościowości pierwiastków.
- Zastosowania "krzyżówki wartościowości" (lub logicznego myślenia) do ustalenia ilości atomów każdego pierwiastka.
Pamiętaj, praktyka czyni mistrza! Im więcej przykładów przećwiczysz, tym łatwiej będzie Ci to robić.
Powodzenia!