Chemia to fascynująca dziedzina nauki. Zajmuje się badaniem materii i jej przemian. Zaczniemy od podstawowego elementu materii – atomu. Zrozumienie budowy atomu jest kluczowe do dalszej nauki chemii.
Podstawowe Definicje
Atom to najmniejsza, niepodzielna (w sensie chemicznym) część pierwiastka. Zachowuje jego właściwości chemiczne. Atomy łączą się ze sobą, tworząc cząsteczki i związki chemiczne. Przykładowo, dwa atomy wodoru (H) łączą się tworząc cząsteczkę wodoru (H2).
Pierwiastek chemiczny to substancja, która składa się z atomów o tej samej liczbie atomowej. Przykładami pierwiastków są tlen (O), węgiel (C) i żelazo (Fe). Pierwiastki są uporządkowane w układzie okresowym pierwiastków.
Budowa Atomu
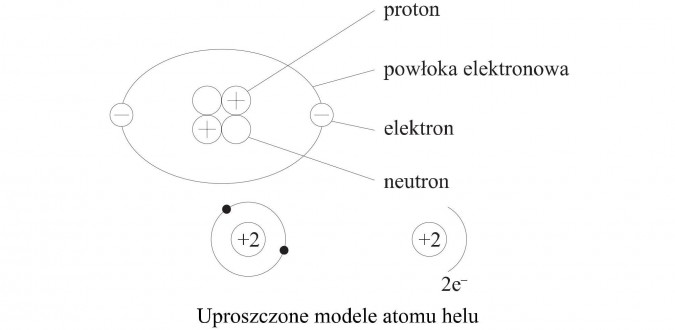
Atom nie jest strukturą niepodzielną. Składa się z mniejszych cząstek, zwanych cząstkami subatomowymi. Do najważniejszych z nich należą protony, neutrony i elektrony. Te cząstki determinują właściwości atomu.
Jądro Atomowe
W centrum atomu znajduje się jądro atomowe. Składa się ono z protonów i neutronów. Protony mają ładunek dodatni (+1). Neutrony są elektrycznie obojętne (nie mają ładunku). Masa protonu i neutronu jest w przybliżeniu taka sama.
Liczba protonów w jądrze atomowym jest charakterystyczna dla danego pierwiastka. Nazywana jest liczbą atomową (Z). Liczba atomowa określa, jaki to pierwiastek. Na przykład, każdy atom węgla (C) ma 6 protonów (Z = 6).
Suma protonów i neutronów w jądrze atomowym to liczba masowa (A). Różne atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Takie atomy nazywamy izotopami. Na przykład, węgiel-12 (12C) ma 6 protonów i 6 neutronów, a węgiel-14 (14C) ma 6 protonów i 8 neutronów.
Elektrony
Wokół jądra atomowego krążą elektrony. Mają one ładunek ujemny (-1). Masa elektronu jest bardzo mała w porównaniu z masą protonu lub neutronu. Praktycznie pomija się ją w obliczeniach masy atomowej.
Elektrony nie krążą po ustalonych orbitach wokół jądra. Znajdują się w określonych obszarach przestrzeni wokół jądra, zwanych orbitalami atomowymi. Orbital atomowy to obszar, w którym prawdopodobieństwo znalezienia elektronu jest największe.
Elektrony rozmieszczone są na różnych powłokach elektronowych (zwanych też poziomami energetycznymi). Powłoki oznacza się literami: K, L, M, N, O, P, Q (lub numerami: 1, 2, 3, 4, 5, 6, 7). Powłoka K (n=1) jest najbliżej jądra i ma najniższą energię. Każda powłoka może pomieścić określoną maksymalną liczbę elektronów. Maksymalna liczba elektronów na powłoce n wynosi 2n2. Na przykład, powłoka K (n=1) może pomieścić maksymalnie 2 elektrony, powłoka L (n=2) może pomieścić maksymalnie 8 elektronów, a powłoka M (n=3) może pomieścić maksymalnie 18 elektronów.
Konfiguracja Elektronowa
Konfiguracja elektronowa to rozmieszczenie elektronów na poszczególnych powłokach elektronowych atomu. Zapis konfiguracji elektronowej pokazuje, ile elektronów znajduje się na każdej powłoce. Na przykład, konfiguracja elektronowa sodu (Na, Z = 11) to 1s22s22p63s1 lub [Ne]3s1, co oznacza, że ma 2 elektrony na powłoce K, 8 elektronów na powłoce L i 1 elektron na powłoce M. Krótki zapis konfiguracji wykorzystuje symbol gazu szlachetnego poprzedzającego dany pierwiastek w układzie okresowym.
Elektrony znajdujące się na zewnętrznej powłoce elektronowej nazywamy elektronami walencyjnymi. Elektrony walencyjne odgrywają kluczową rolę w tworzeniu wiązań chemicznych. Określają właściwości chemiczne pierwiastka. Atomy dążą do uzyskania stabilnej konfiguracji elektronowej, czyli takiej, w której zewnętrzna powłoka jest w pełni zapełniona (najczęściej 8 elektronów, tzw. oktet elektronowy, lub 2 elektrony dla wodoru i helu, tzw. dublet elektronowy).
Jonizacja
Jonizacja to proces, w którym atom traci lub zyskuje elektrony. Jeśli atom traci elektrony, staje się kationem (jonem o ładunku dodatnim). Jeśli atom zyskuje elektrony, staje się anionem (jonem o ładunku ujemnym). Na przykład, atom sodu (Na) łatwo traci jeden elektron, tworząc kation sodu (Na+). Atom chloru (Cl) łatwo zyskuje jeden elektron, tworząc anion chlorkowy (Cl-).
Zastosowania Wiedzy o Budowie Atomu
Zrozumienie budowy atomu ma ogromne znaczenie w wielu dziedzinach nauki i technologii. Pozwala na projektowanie nowych materiałów o określonych właściwościach. Jest też podstawą w medycynie (np. w diagnostyce obrazowej, jak rezonans magnetyczny), energetyce jądrowej i wielu innych dziedzinach.
Na przykład, znajomość konfiguracji elektronowej pozwala przewidzieć, jakie wiązania chemiczne utworzy dany atom. Dzięki temu można projektować leki, tworzywa sztuczne i inne substancje o pożądanych właściwościach. Wiedza o izotopach promieniotwórczych jest wykorzystywana w datowaniu archeologicznym i medycynie nuklearnej.
Budowa atomu to fundament chemii. Zrozumienie tej koncepcji otwiera drzwi do dalszej eksploracji fascynującego świata materii i jej przemian. Kolejne kroki to wiązania chemiczne, reakcje chemiczne i cała reszta, która sprawia, że chemia jest tak ważna i interesująca.