Chemia jest wszędzie wokół nas. Zrozumienie podstawowych związków chemicznych jest kluczowe do pojmowania świata. Zajmiemy się teraz czterema ważnymi grupami związków nieorganicznych: tlenkami, wodorotlenkami, kwasami i solami.
Tlenki
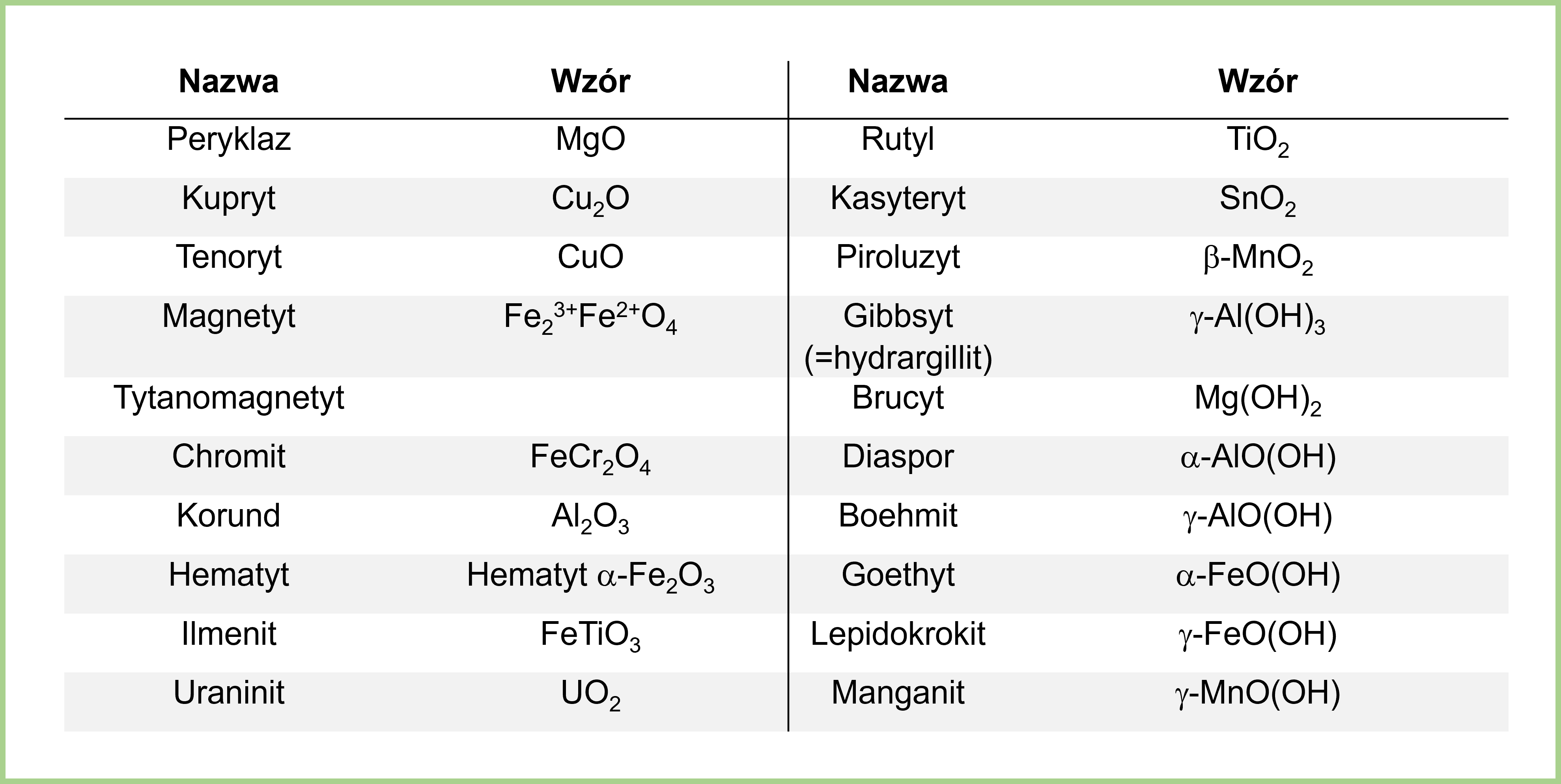
Tlenki to związki chemiczne, które składają się z tlenu i innego pierwiastka. Tlen musi być bardziej elektroujemny niż drugi pierwiastek w związku. Ogólny wzór tlenków to ExOy, gdzie E oznacza pierwiastek, a x i y to liczby atomów.
Przykłady tlenków to: tlenek węgla(IV) (CO2), tlenek żelaza(III) (Fe2O3) i tlenek magnezu (MgO). Tlenek węgla(IV) powstaje podczas spalania paliw. Tlenek żelaza(III) jest głównym składnikiem rdzy. Tlenek magnezu stosuje się w medycynie.
Tlenki można klasyfikować ze względu na ich charakter chemiczny. Mamy tlenki kwasowe, zasadowe, amfoteryczne i obojętne. Tlenki kwasowe reagują z wodą tworząc kwasy (np. SO3 + H2O → H2SO4). Tlenki zasadowe reagują z wodą tworząc zasady (np. Na2O + H2O → 2NaOH). Tlenki amfoteryczne reagują zarówno z kwasami, jak i zasadami. Tlenki obojętne nie reagują ani z kwasami, ani z zasadami.
Wodorotlenki
Wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową (OH-) związaną z metalem. Mają ogólny wzór M(OH)n, gdzie M to metal, a n to jego wartościowość. Grupa wodorotlenowa nadaje im charakter zasadowy.
Do popularnych wodorotlenków należą: wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH) i wodorotlenek wapnia (Ca(OH)2). Wodorotlenek sodu, znany również jako soda kaustyczna, używany jest w produkcji mydła i papieru. Wodorotlenek potasu, czyli potaż żrący, znajduje zastosowanie w produkcji nawozów. Wodorotlenek wapnia, czyli wapno gaszone, stosuje się w budownictwie.
Wodorotlenki metali alkalicznych (grupa 1 w układzie okresowym) są silnymi zasadami. Wodorotlenki metali ziem alkalicznych (grupa 2) są słabszymi zasadami. Rozpuszczalność wodorotlenków w wodzie jest zróżnicowana.
Kwasy
Kwasy to związki chemiczne, które w roztworach wodnych dysocjują na jony wodorowe (H+) i aniony. Charakteryzują się kwaśnym smakiem (ostrożnie, nie próbuj kwasów laboratoryjnych!). Zmieniają barwę wskaźników pH (np. lakmus barwi się na czerwono).
Rozróżniamy kwasy tlenowe i beztlenowe. Kwasy beztlenowe zawierają wodór i niemetal (np. HCl - kwas chlorowodorowy). Kwasy tlenowe zawierają wodór, tlen i niemetal (np. H2SO4 - kwas siarkowy(VI)).
Przykłady ważnych kwasów to: kwas solny (HCl) – obecny w żołądku, pomaga w trawieniu. Kwas siarkowy(VI) (H2SO4) – używany w przemyśle chemicznym i akumulatorach. Kwas azotowy(V) (HNO3) – stosowany do produkcji nawozów i materiałów wybuchowych.
Moc kwasu zależy od stopnia jego dysocjacji w wodzie. Mocne kwasy dysocjują całkowicie (np. HCl, H2SO4, HNO3). Słabe kwasy dysocjują tylko częściowo (np. CH3COOH - kwas octowy).
Sole
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą (reakcja zobojętniania). Składają się z kationu metalu (lub grupy amonowej NH4+) i anionu reszty kwasowej.
Ogólny wzór soli to MxAy, gdzie M to kation, A to anion, a x i y to odpowiednie liczby atomów wynikające z wartościowości. Przykłady soli to: chlorek sodu (NaCl), siarczan(VI) miedzi(II) (CuSO4) i azotan(V) potasu (KNO3).
Chlorek sodu, czyli sól kuchenna, jest niezbędny do życia. Siarczan(VI) miedzi(II) jest używany jako środek grzybobójczy. Azotan(V) potasu stosuje się jako nawóz.
Sole mogą być obojętne, kwasowe lub zasadowe, w zależności od kwasu i zasady, z których powstały. Sole pochodzące od mocnych kwasów i mocnych zasad są obojętne. Sole pochodzące od mocnych kwasów i słabych zasad są kwasowe. Sole pochodzące od słabych kwasów i mocnych zasad są zasadowe.
Rozpuszczalność soli w wodzie jest różna. Niektóre sole są bardzo dobrze rozpuszczalne, inne słabo rozpuszczalne, a jeszcze inne praktycznie nierozpuszczalne. Rozpuszczalność zależy od rodzaju kationu i anionu, a także od temperatury.
Znajomość tlenków, wodorotlenków, kwasów i soli jest fundamentalna dla zrozumienia chemii. Te związki odgrywają kluczowe role w wielu procesach przemysłowych, biologicznych i środowiskowych. Ich właściwości i reakcje determinują wiele aspektów naszego codziennego życia.