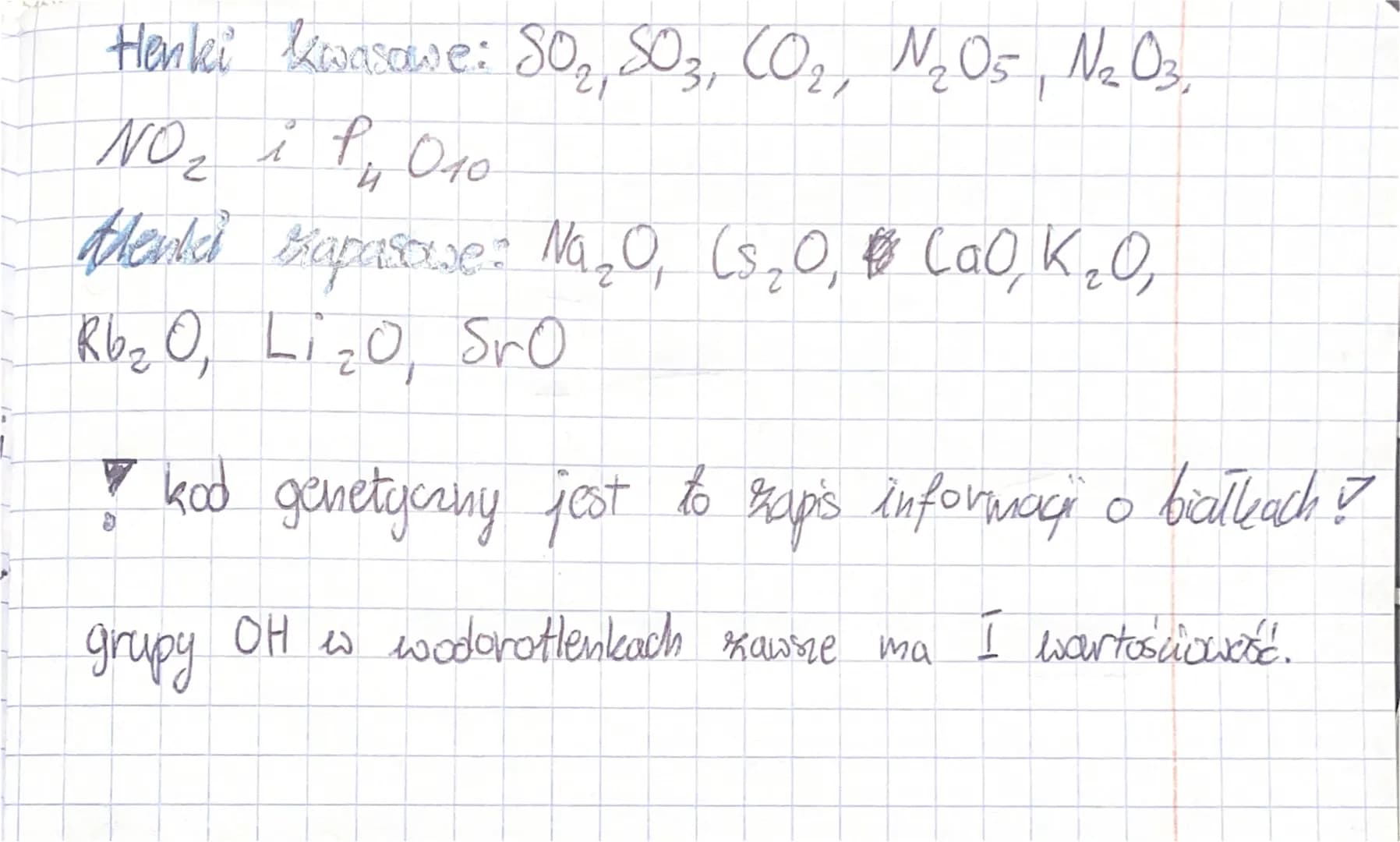Hej uczniowie klasy 7! Przygotowujemy się do sprawdzianu z tlenków i wodorotlenków. Spokojnie, damy radę!
Tlenki: Co musisz wiedzieć?
Zacznijmy od tlenków. To związki chemiczne, które zawierają tlen i inny pierwiastek.
Jak powstają tlenki?
Najczęściej powstają w reakcji łączenia się pierwiastka z tlenem. Pamiętaj o zapisie reakcji chemicznej!
Na przykład: 2Mg + O2 → 2MgO. Tutaj magnez łączy się z tlenem, tworząc tlenek magnezu.
Nazewnictwo tlenków
Nazwa tlenku składa się z dwóch części. Pierwsza to "tlenek", a druga to nazwa pierwiastka, który łączy się z tlenem.
Przykład: MgO to tlenek magnezu. Ale uwaga! Jeśli pierwiastek tworzy kilka tlenków, musimy podać jego wartościowość.
Używamy do tego cyfr rzymskich w nawiasie, np. tlenek żelaza(II) to FeO, a tlenek żelaza(III) to Fe2O3.
Podział tlenków
Dzielimy tlenki ze względu na ich właściwości chemiczne. Ważne są tlenki kwasowe, zasadowe i obojętne.
Tlenki kwasowe reagują z wodą, tworząc kwasy. Przykład: SO2 + H2O → H2SO3.
Tlenki zasadowe reagują z wodą, tworząc zasady. Przykład: Na2O + H2O → 2NaOH.
Tlenki obojętne nie reagują ani z kwasami, ani z zasadami. Przykład: CO.
Wodorotlenki: Co musisz wiedzieć?
Teraz przejdźmy do wodorotlenków. To związki chemiczne, które zawierają metal i grupę wodorotlenową (OH).
Budowa wodorotlenków
Wodorotlenki mają ogólny wzór: M(OH)n, gdzie M to metal, a n to wartościowość metalu.
Przykład: NaOH to wodorotlenek sodu. Sód (Na) ma wartościowość I, więc mamy jedną grupę OH.
Jak powstają wodorotlenki?
Wodorotlenki metali z grupy 1 i 2 układu okresowego powstają w reakcji metalu z wodą.
Przykład: 2Na + 2H2O → 2NaOH + H2. Sód reaguje z wodą, tworząc wodorotlenek sodu i wodór.
Inne wodorotlenki można otrzymać w reakcji tlenku zasadowego z wodą. (patrz wyżej w tlenkach).
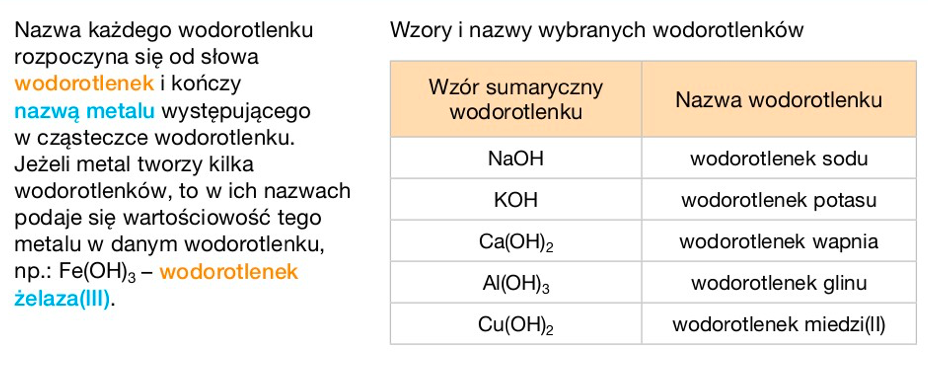
Nazewnictwo wodorotlenków
Nazwa wodorotlenku składa się z dwóch części. Pierwsza to "wodorotlenek", a druga to nazwa metalu.
Przykład: KOH to wodorotlenek potasu. Tak jak przy tlenkach, jeśli metal tworzy kilka wodorotlenków, musimy podać jego wartościowość.
Używamy do tego cyfr rzymskich w nawiasie, np. wodorotlenek żelaza(II) to Fe(OH)2, a wodorotlenek żelaza(III) to Fe(OH)3.
Właściwości wodorotlenków
Wodorotlenki są substancjami stałymi. Wodorotlenki metali z grupy 1 (np. NaOH, KOH) są bardzo dobrze rozpuszczalne w wodzie. Nazywamy je zasadami.
Roztwory wodorotlenków mają odczyn zasadowy. Oznacza to, że zmieniają barwę wskaźników.
Na przykład, fenoloftaleina w roztworze wodorotlenku staje się malinowa, a papierek uniwersalny barwi się na niebiesko lub granatowo.
Zastosowanie wodorotlenków
Wodorotlenki mają wiele zastosowań. Wodorotlenek sodu (NaOH) używany jest do produkcji mydła, papieru i do udrażniania rur.
Wodorotlenek wapnia (Ca(OH)2) używany jest w budownictwie (jako składnik zaprawy murarskiej) i w rolnictwie (do odkwaszania gleby).
Reakcje zobojętniania
Reakcja zobojętniania to reakcja kwasu z zasadą (czyli roztworem wodorotlenku metalu z grupy 1 lub 2). W wyniku tej reakcji powstaje sól i woda.
Przykład: HCl + NaOH → NaCl + H2O. Kwas solny reaguje z wodorotlenkiem sodu, tworząc chlorek sodu (sól kuchenną) i wodę.
Podsumowanie
Pamiętaj, że tlenki to związki tlenu z innym pierwiastkiem. Rozróżniamy tlenki kwasowe, zasadowe i obojętne. Musisz umieć pisać wzory i nazwy tlenków!
Wodorotlenki zawierają metal i grupę wodorotlenową (OH). Wodorotlenki metali z grupy 1 i 2 rozpuszczają się w wodzie, tworząc zasady.
Wodorotlenki barwią wskaźniki. Pamiętaj o reakcji zobojętniania, w której kwas reaguje z zasadą, tworząc sól i wodę.
Powodzenia na sprawdzianie! Wierzę w Ciebie!