Zacznijmy naszą podróż po świecie chemii! Dziś zajmiemy się dwiema ważnymi grupami związków: tlenkami i wodorotlenkami. Są one bardzo powszechne i mają wiele zastosowań w naszym codziennym życiu.
Tlenki
Tlenki to związki chemiczne, które składają się z dwóch pierwiastków: tlenu i innego pierwiastka. Tlen w tlenkach zawsze występuje na -II stopniu utlenienia. Oznacza to, że każdy atom tlenu „przyjmuje” dwa elektrony.
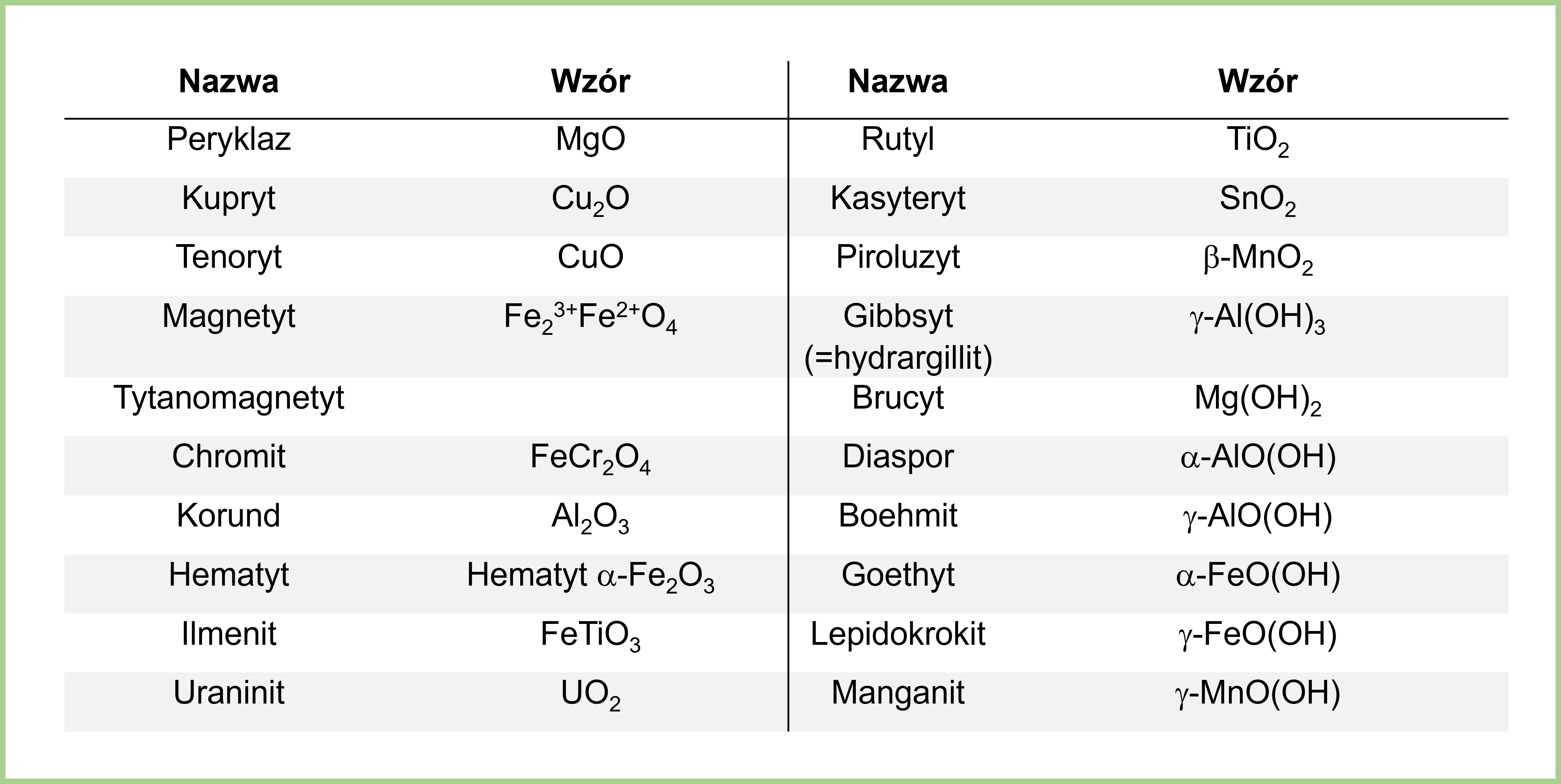
Wzór ogólny tlenku to ExOy, gdzie E to symbol pierwiastka, a x i y to liczby atomów danego pierwiastka w cząsteczce. Przykłady to tlenek magnezu (MgO), tlenek węgla(IV) (CO2) i tlenek glinu (Al2O3).
Nazewnictwo Tlenków
Nazwy tlenków tworzymy, podając słowo "tlenek" i nazwę pierwiastka, który łączy się z tlenem. Jeżeli pierwiastek tworzy więcej niż jeden tlenek, po nazwie pierwiastka podajemy w nawiasie jego wartościowość (inaczej stopień utlenienia) w tym tlenku, zapisywaną cyframi rzymskimi. Na przykład, żelazo tworzy dwa tlenki: tlenek żelaza(II) (FeO) i tlenek żelaza(III) (Fe2O3).
Inny przykład: Miedź tworzy dwa tlenki. Tlenek miedzi (I) – Cu2O oraz tlenek miedzi (II) – CuO. W pierwszym związku miedź ma wartościowość I, a w drugim – II. Pamiętajmy o nawiasach i cyfrach rzymskich!
Właściwości Tlenków
Właściwości tlenków są bardzo zróżnicowane. Mogą to być substancje stałe, ciekłe lub gazowe. Niektóre tlenki reagują z wodą, tworząc kwasy lub zasady. Inne są bardzo odporne na działanie wysokich temperatur. Przykładem jest tlenek glinu (Al2O3), który jest składnikiem korundu, czyli bardzo twardego minerału.
Tlenki metali zwykle mają charakter zasadowy (reagują z kwasami), a tlenki niemetali mają charakter kwasowy (reagują z zasadami). Istnieją także tlenki amfoteryczne, które mogą reagować zarówno z kwasami, jak i zasadami, np. tlenek glinu.
Przykłady i Zastosowania Tlenków
Tlenki otaczają nas wszędzie. Woda (H2O) jest tlenkiem wodoru. Dwutlenek węgla (CO2) powstaje podczas oddychania i spalania. Tlenek krzemu(IV) (SiO2), czyli piasek, jest podstawowym składnikiem szkła.
Tlenki mają wiele zastosowań. Tlenek magnezu (MgO) stosuje się w medycynie jako środek zobojętniający kwas żołądkowy. Tlenek cynku (ZnO) jest składnikiem kremów z filtrem UV. Tlenek żelaza(III) (Fe2O3) to popularny barwnik, używany m.in. do produkcji farb.
Wodorotlenki
Teraz przejdźmy do wodorotlenków. Wodorotlenki to związki chemiczne, które zawierają metal i grupę wodorotlenową (OH-). Grupa wodorotlenowa ma ładunek ujemny i występuje jako całość.
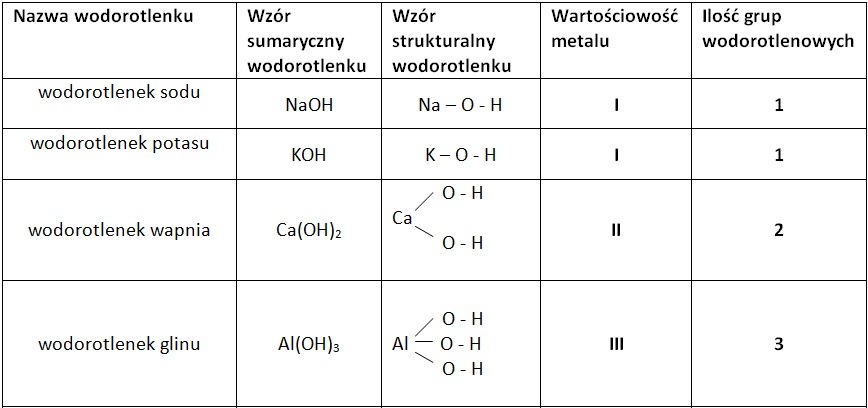
Wzór ogólny wodorotlenku to M(OH)n, gdzie M to symbol metalu, a n to wartościowość metalu. Przykłady to wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH) i wodorotlenek wapnia (Ca(OH)2).
Nazewnictwo Wodorotlenków
Nazwy wodorotlenków tworzymy, podając słowo "wodorotlenek" i nazwę metalu. Podobnie jak w przypadku tlenków, jeżeli metal tworzy więcej niż jeden wodorotlenek, po nazwie metalu podajemy w nawiasie jego wartościowość (stopień utlenienia). Na przykład, żelazo tworzy dwa wodorotlenki: wodorotlenek żelaza(II) (Fe(OH)2) i wodorotlenek żelaza(III) (Fe(OH)3).
Wodorotlenek miedzi (I) – CuOH oraz wodorotlenek miedzi (II) – Cu(OH)2. Metal ma wartościowość I lub II. Trzeba pamiętać o poprawnym zapisie wzorów i nazw.
Właściwości Wodorotlenków
Wodorotlenki metali z grupy I i II układu okresowego (z wyjątkiem berylu i magnezu) to zasady. Oznacza to, że rozpuszczają się w wodzie, tworząc roztwory o odczynie zasadowym. Zasady powodują zmianę barwy wskaźników, np. fenoloftaleina w obecności zasad barwi się na malinowo.
Wodorotlenki są substancjami stałymi, często o białej lub lekko zabarwionej barwie. Są żrące i należy z nimi obchodzić się ostrożnie. Niektóre wodorotlenki, takie jak wodorotlenek glinu (Al(OH)3), mają właściwości amfoteryczne.
Przykłady i Zastosowania Wodorotlenków
Wodorotlenek sodu (NaOH), czyli soda kaustyczna, jest używany do produkcji mydła, papieru i detergentów. Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone, stosuje się w budownictwie i rolnictwie do odkwaszania gleby.
Wodorotlenek magnezu (Mg(OH)2), czyli mleko magnezjowe, jest stosowany jako środek zobojętniający kwas żołądkowy i przeczyszczający. Wodorotlenek glinu (Al(OH)3) jest składnikiem niektórych leków na zgagę i jest stosowany w procesach oczyszczania wody.
Wodorotlenki odgrywają kluczową rolę w neutralizacji kwasów i zasad. Wiele procesów przemysłowych i naturalnych opiera się na reakcjach z udziałem wodorotlenków.
Mam nadzieję, że teraz rozumiesz, czym są tlenki i wodorotlenki. Pamiętaj, że chemia jest wszędzie wokół nas, a zrozumienie podstawowych pojęć pozwala lepiej rozumieć świat!