Chemia w ósmej klasie obejmuje wiele ciekawych tematów. Jednym z ważniejszych są tlenki i wodorotlenki. Zrozumienie ich budowy i właściwości jest kluczowe. To podstawa do dalszej nauki o związkach chemicznych.
Tlenki
Tlenki to związki chemiczne. Powstają, gdy tlen łączy się z innym pierwiastkiem. Wzór ogólny tlenku to ExOy, gdzie E to pierwiastek, a O to tlen. Indeksy x i y wskazują na liczbę atomów danego pierwiastka w cząsteczce.
Nazewnictwo Tlenków
Nazwa tlenku tworzona jest od nazwy pierwiastka. Dodaje się słowo "tlenek". Jeżeli pierwiastek tworzy kilka tlenków, podaje się jego wartościowość w nawiasie, cyfrą rzymską. Przykładowo, tlenek żelaza(II) to FeO, a tlenek żelaza(III) to Fe2O3. Wartościowość tlenu jest zawsze równa II.
Przykłady Tlenków
Istnieje wiele tlenków. Tlenek magnezu (MgO) to białe ciało stałe. Dwutlenek węgla (CO2) to gaz, który wydychamy. Tlenek glinu (Al2O3) jest składnikiem korundu, minerału o dużej twardości. Tlenki mogą mieć różne stany skupienia w temperaturze pokojowej.
Właściwości Tlenków
Właściwości tlenków zależą od pierwiastka, z którym połączył się tlen. Niektóre tlenki reagują z wodą, tworząc kwasy lub zasady. Inne reagują z kwasami lub zasadami, tworząc sole. Tlenki metali zazwyczaj mają charakter zasadowy, a tlenki niemetali – kwasowy.
Podział tlenków ze względu na charakter chemiczny jest bardzo ważny. Wyróżniamy tlenki kwasowe, zasadowe, amfoteryczne i obojętne. Tlenki kwasowe reagują z zasadami, zasadowe z kwasami, amfoteryczne zarówno z kwasami, jak i zasadami, a obojętne nie reagują ani z kwasami, ani z zasadami.
Wodorotlenki
Wodorotlenki to związki chemiczne. Zawierają kation metalu i anion wodorotlenkowy (OH-). Wzór ogólny wodorotlenku to M(OH)n, gdzie M to metal, a n to wartościowość metalu. Grupa OH nazywana jest grupą wodorotlenową.
Nazewnictwo Wodorotlenków
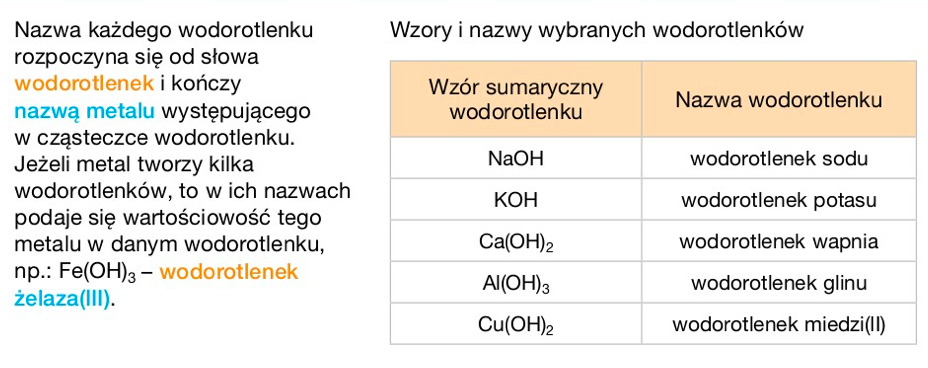
Nazwa wodorotlenku tworzona jest od nazwy metalu. Dodaje się słowo "wodorotlenek". Jeżeli metal tworzy kilka wodorotlenków, podaje się jego wartościowość w nawiasie, cyfrą rzymską. Na przykład, wodorotlenek sodu to NaOH, a wodorotlenek żelaza(II) to Fe(OH)2.
Przykłady Wodorotlenków
Wodorotlenek sodu (NaOH), czyli soda kaustyczna, jest silną zasadą. Wodorotlenek potasu (KOH) jest podobny do wodorotlenku sodu. Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone, stosowany jest w budownictwie. Wodorotlenki metali alkalicznych (grupa 1 układu okresowego) są dobrze rozpuszczalne w wodzie.
Właściwości Wodorotlenków
Wodorotlenki metali alkalicznych i metali ziem alkalicznych są zasadami. Rozpuszczają się w wodzie, tworząc roztwory o odczynie zasadowym. Wodorotlenki innych metali są na ogół nierozpuszczalne w wodzie. Wodorotlenki reagują z kwasami, tworząc sole i wodę (reakcja zobojętniania).
Zasady to wodorotlenki, które rozpuszczają się w wodzie. Ich roztwory mają odczyn zasadowy. Zasady barwią wskaźniki (np. papierek lakmusowy) na niebiesko. Są śliskie w dotyku i żrące.
Reakcje Chemiczne z Udziałem Tlenków i Wodorotlenków
Tlenki i wodorotlenki uczestniczą w wielu reakcjach chemicznych. Ważną reakcją jest reakcja tlenku metalu z kwasem. Powstaje wtedy sól i woda. Reakcja tlenku niemetalu z zasadą również prowadzi do powstania soli i wody.
Reakcja zobojętniania to reakcja kwasu z zasadą. Produktami reakcji są sól i woda. Na przykład: HCl + NaOH → NaCl + H2O. Ta reakcja jest wykorzystywana do neutralizacji kwasów i zasad.
Tlenki mogą reagować ze sobą. Na przykład, tlenek wapnia (CaO) reaguje z dwutlenkiem krzemu (SiO2) w wysokiej temperaturze, tworząc krzemian wapnia (CaSiO3). Ta reakcja jest wykorzystywana w produkcji szkła.
Zastosowania Tlenków i Wodorotlenków
Tlenki i wodorotlenki mają szerokie zastosowanie. Tlenek wapnia (CaO) używany jest w budownictwie jako składnik zaprawy murarskiej. Dwutlenek krzemu (SiO2) jest głównym składnikiem szkła. Tlenek tytanu(IV) (TiO2) stosowany jest jako biały pigment w farbach i kosmetykach. Wodorotlenek sodu (NaOH) używany jest w produkcji mydła i papieru.
W przemyśle spożywczym niektóre tlenki są używane jako barwniki. Tlenek żelaza(III) (Fe2O3) może być używany do barwienia produktów na czerwono. Tlenki metali są również używane jako katalizatory w różnych procesach chemicznych.
Tlenki i wodorotlenki są niezbędne w naszym życiu. Znajdują zastosowanie w wielu dziedzinach, od budownictwa po medycynę. Zrozumienie ich właściwości i reakcji jest kluczowe dla rozwoju nauki i technologii.