Hej! Nadchodzi test z tlenków i wodorotlenków? Nie martw się! Razem to ogarniemy. To będzie łatwe, jeśli dobrze się przygotujemy.
Tlenki – Co to takiego?
Tlenki to związki chemiczne. Powstają, gdy tlen łączy się z innym pierwiastkiem. Pamiętaj: *tlen* + *inny pierwiastek* = *tlenek*!
Podział tlenków
Mamy różne rodzaje tlenków. Najważniejsze to:
- Tlenki metali: Tlen łączy się z metalem (np. tlenek sodu – Na2O).
- Tlenki niemetali: Tlen łączy się z niemetalem (np. tlenek węgla(IV) – CO2).
- Tlenki kwasowe: Reagują z wodą, tworząc kwasy (np. SO3). Często są to tlenki niemetali.
- Tlenki zasadowe: Reagują z wodą, tworząc zasady (np. Na2O). Są to zazwyczaj tlenki metali.
- Tlenki obojętne: Nie reagują ani z kwasami, ani z zasadami, ani z wodą (np. CO).
Zapamiętaj te rodzaje! To bardzo ważne na teście.
Nazewnictwo tlenków
Jak nazywamy tlenki? To proste!
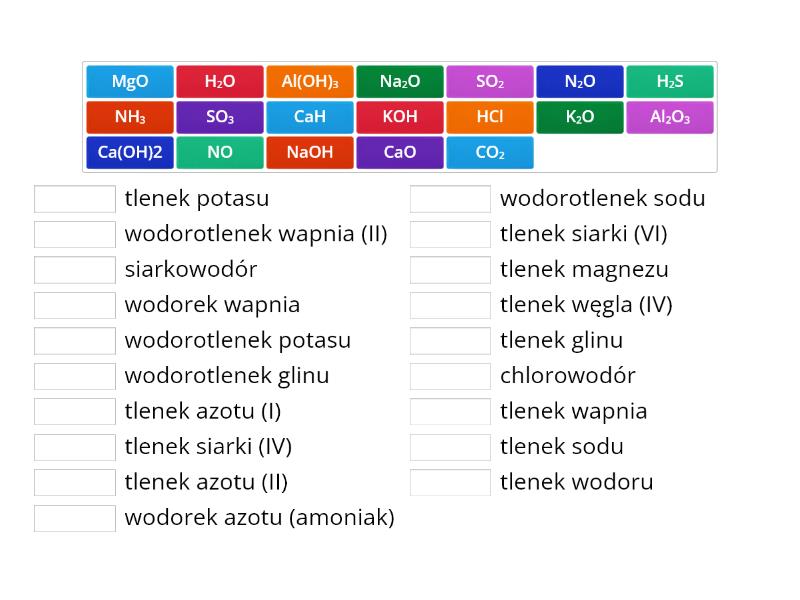
Nazwa tlenku = "tlenek" + nazwa pierwiastka + (wartościowość pierwiastka – jeśli ma więcej niż jedną wartościowość, zapisana cyfrą rzymską w nawiasie).
Przykłady:
- Tlenek magnezu – MgO (magnez ma jedną wartościowość, więc nie piszemy jej w nawiasie).
- Tlenek żelaza(II) – FeO (żelazo ma dwie wartościowości, II i III).
- Tlenek żelaza(III) – Fe2O3.
Ćwicz! Im więcej przykładów przeanalizujesz, tym łatwiej zapamiętasz.
Wodorotlenki – Co to takiego?
Wodorotlenki to związki chemiczne. Zawierają grupę wodorotlenową (OH-).
Wodorotlenek = metal + grupa wodorotlenowa (OH).
Budowa wodorotlenków
Wodorotlenki składają się z kationu metalu (ładunek dodatni) i anionu wodorotlenkowego (OH-, ładunek ujemny).
Przykład: W wodorotlenku sodu (NaOH) mamy kation sodu (Na+) i anion wodorotlenkowy (OH-).
Otrzymywanie wodorotlenków
Wodorotlenki metali aktywnych (np. sód, potas) otrzymujemy przez reakcję metalu z wodą.
Przykład: 2Na + 2H2O → 2NaOH + H2
Wodorotlenki metali słabo aktywnych (nierozpuszczalne w wodzie) otrzymujemy przez reakcję soli z zasadą.
Przykład: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Nazewnictwo wodorotlenków
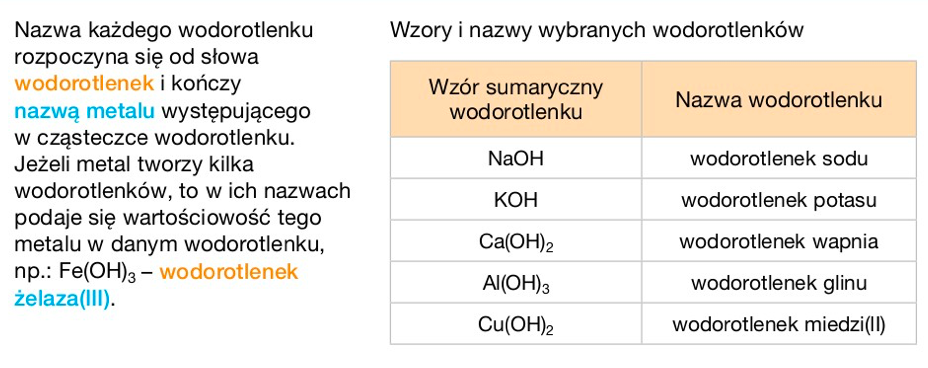
Nazwa wodorotlenku = "wodorotlenek" + nazwa metalu + (wartościowość metalu – jeśli ma więcej niż jedną wartościowość, zapisana cyfrą rzymską w nawiasie).
Przykłady:
- Wodorotlenek sodu – NaOH (sód ma jedną wartościowość).
- Wodorotlenek żelaza(II) – Fe(OH)2.
- Wodorotlenek żelaza(III) – Fe(OH)3.
Właściwości wodorotlenków
Ważne właściwości wodorotlenków:
- Mają odczyn zasadowy.
- W roztworach wodnych dysocjują na jony: metalu (kation) i wodorotlenkowe (anion).
- Reagują z kwasami, tworząc sole i wodę (reakcja zobojętniania).
Zrozumienie tych właściwości pomoże Ci w zadaniach na teście.
Przykłady wodorotlenków
- Wodorotlenek sodu (NaOH) – używany do produkcji mydła, papieru. Jest silnie żrący!
- Wodorotlenek potasu (KOH) – podobny do NaOH, również używany w przemyśle.
- Wodorotlenek wapnia (Ca(OH)2) – znany jako wapno gaszone, używany w budownictwie.
- Wodorotlenek glinu (Al(OH)3) – składnik leków na zgagę.
Reakcje charakterystyczne
Ważne reakcje do zapamiętania:
- Reakcja tlenku metalu z wodą (tworzenie wodorotlenku): Na2O + H2O → 2NaOH
- Reakcja tlenku niemetalu z wodą (tworzenie kwasu): SO3 + H2O → H2SO4
- Reakcja zobojętniania (kwas + zasada → sól + woda): HCl + NaOH → NaCl + H2O
Jak się uczyć?
Oto kilka wskazówek:
- Przerabiaj zadania z podręcznika i zeszytu ćwiczeń.
- Twórz fiszki z nazwami i wzorami tlenków i wodorotlenków.
- Wyjaśniaj materiał komuś innemu – to pomaga utrwalić wiedzę.
- Rób przerwy! Krótkie, ale regularne sesje nauki są bardziej efektywne niż długie i męczące.
Podsumowanie
Na teście z tlenków i wodorotlenków pamiętaj o:
- Definicjach tlenków i wodorotlenków.
- Podziale tlenków (kwasowe, zasadowe, obojętne).
- Nazewnictwie tlenków i wodorotlenków.
- Właściwościach wodorotlenków (odczyn zasadowy, dysocjacja, reakcje zobojętniania).
- Przykładach tlenków i wodorotlenków oraz ich zastosowaniach.
- Równaniach reakcji.
Dasz radę! Powodzenia na teście! Wierzę w Ciebie!