Przygotuj się na fascynującą podróż w świat chemii! Dziś zagłębimy się w temat Tlenku Węgla(II), znanego również jako czad. Zrozumiemy jego wzór elektronowy. Będziemy analizować krok po kroku strukturę tego niebezpiecznego, ale intrygującego związku. Spokojnie, wszystko wyjaśnimy w prosty i przystępny sposób.
Co to jest Tlenek Węgla(II)?
Tlenek Węgla(II), o wzorze CO, to bezbarwny i bezwonny gaz. Jest bardzo trujący. Powstaje w wyniku niepełnego spalania materiałów zawierających węgiel. Proces zachodzi przy ograniczonym dostępie tlenu. To kluczowa informacja, która pozwoli nam zrozumieć, dlaczego jest tak groźny.
Wyobraź sobie ognisko, które dymi gęstym, szarym dymem. Albo piec, w którym brakuje dopływu powietrza. To właśnie tam powstaje Tlenek Węgla(II). Niestety, nie możemy go zobaczyć ani poczuć, co czyni go szczególnie niebezpiecznym.
Wzór Elektronowy - Podstawa Rozumienia
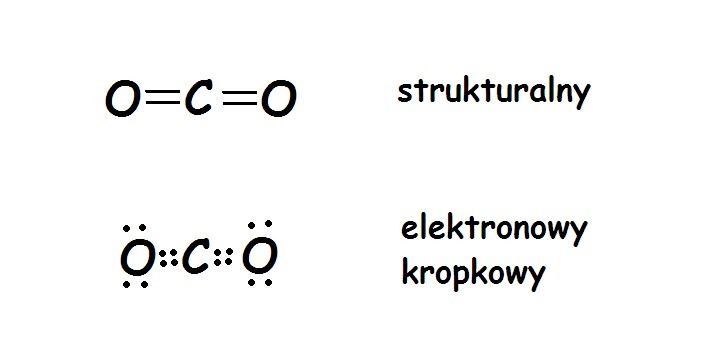
Wzór elektronowy, nazywany także strukturą Lewisa, to sposób przedstawienia wiązań chemicznych w cząsteczce. Używamy kropek lub kresek, aby pokazać, jak atomy dzielą się elektronami. Dzięki temu możemy lepiej zrozumieć, jak atomy łączą się ze sobą, tworząc cząsteczkę. To jak mapa drogowa dla elektronów!
Zanim przejdziemy do samego Tlenku Węgla(II), przypomnijmy sobie podstawowe zasady. Każdy atom dąży do uzyskania oktetu elektronowego. Oznacza to, że chce mieć osiem elektronów na swojej zewnętrznej powłoce. Wyjątkiem jest wodór, który dąży do dubletu, czyli dwóch elektronów.
Węgiel i Tlen - Kluczowi Gracze
Teraz przyjrzyjmy się bliżej atomom węgla (C) i tlenu (O). Węgiel ma liczbę atomową 6. Oznacza to, że ma 6 elektronów. Jego konfiguracja elektronowa to 1s2 2s2 2p2. Na zewnętrznej powłoce ma 4 elektrony walencyjne. Potrzebuje jeszcze 4, aby osiągnąć oktet.
Tlen ma liczbę atomową 8. Ma więc 8 elektronów. Jego konfiguracja elektronowa to 1s2 2s2 2p4. Na zewnętrznej powłoce ma 6 elektronów walencyjnych. Potrzebuje tylko 2, aby osiągnąć oktet.
Tworzenie Wiązań w Tlenku Węgla(II)
Atomy węgla i tlenu chcą osiągnąć oktet. Dlatego dzielą się elektronami. W Tlenku Węgla(II) między atomami węgla i tlenu powstaje wiązanie potrójne. To oznacza, że dzielą się aż sześcioma elektronami!
Spójrzmy na to krok po kroku. Węgiel oddaje 2 elektrony do wspólnego użytku. Tlen robi to samo. Razem mają już 4 elektrony. Ale to wciąż za mało. Węgiel i tlen dzielą się jeszcze jedną parą elektronów. W sumie tworzą trzy wiązania. Zatem węgiel ma 2 elektrony własne i 6 dzielonych, a tlen ma 4 elektrony własne i 6 dzielonych. Wzór elektronowy CO wygląda następująco: :C≡O:
Zwróć uwagę na kropki wokół symboli atomów. Reprezentują one niewiążące pary elektronowe. Tlen ma dwie takie pary. Węgiel, wbrew pozorom, również ma jedną parę niewiążącą.
Formalny Ładunek - Dopełnienie Obrazu
Aby jeszcze lepiej zrozumieć strukturę Tlenku Węgla(II), warto wspomnieć o ładunku formalnym. Jest to koncepcja, która pomaga ocenić, jak dobrze rozłożone są elektrony w cząsteczce. Oblicza się go, porównując liczbę elektronów walencyjnych atomu w stanie wolnym z liczbą elektronów, które przypisujemy mu w cząsteczce.
Dla węgla w CO ładunek formalny wynosi -1. Oznacza to, że ma "za dużo" elektronów. Tlen ma ładunek formalny +1. Ma "za mało" elektronów. To sugeruje, że struktura :C≡O: nie jest idealna. Istnieją alternatywne struktury rezonansowe, które lepiej opisują rozkład elektronów. Niektóre z nich, choć mniej stabilne, mogą mieć większy udział w strukturze rzeczywistej cząsteczki.
Dlaczego Tlenek Węgla(II) jest Taki Niebezpieczny?
Teraz, gdy rozumiemy strukturę Tlenku Węgla(II), możemy lepiej zrozumieć, dlaczego jest tak toksyczny. CO wiąże się z hemoglobiną we krwi znacznie silniej niż tlen. Uniemożliwia to transport tlenu do komórek organizmu. To prowadzi do niedotlenienia, uszkodzenia narządów i w konsekwencji do śmierci.
Pamiętaj, że Tlenek Węgla(II) jest niewidoczny i bezwonny. Dlatego tak ważne są czujniki czadu w domach. Mogą uratować życie! Regularnie sprawdzaj sprawność pieców i kominków. Zapewnij odpowiednią wentylację w pomieszczeniach, w których spalane są paliwa.
Podsumowanie
Mam nadzieję, że ta podróż po świecie Tlenku Węgla(II) była dla Ciebie pouczająca. Dowiedzieliśmy się, czym jest ten związek, jak powstaje, jak wygląda jego wzór elektronowy i dlaczego jest tak niebezpieczny. Zrozumienie struktury cząsteczki pozwala nam lepiej zrozumieć jej właściwości i zagrożenia z nią związane.
Pamiętaj, że chemia jest wszędzie! Otacza nas w życiu codziennym. Im lepiej ją rozumiemy, tym bardziej świadomi i bezpieczni jesteśmy.