Witaj! Przygotuj się na fascynującą podróż po świecie Testu Z Wodorotlenków Chemia Nowej Ery 2.
Wyobraź sobie, że wodorotlenki to cegły budujące dom chemii. Różne cegły, różne domy.
Czym są wodorotlenki?
Wodorotlenki to związki chemiczne, które zawierają grupę wodorotlenową (OH-).
Pomyśl o OH- jak o kluczu, który otwiera drzwi do reakcji.
Są jak ekipa sprzątająca w chemicznym bałaganie, neutralizują kwasy.
Budowa wodorotlenków
Wodorotlenek składa się z metalu połączonego z jedną lub kilkoma grupami wodorotlenowymi.
Metal to silny zawodnik, a grupa OH to jego wierny pomocnik.
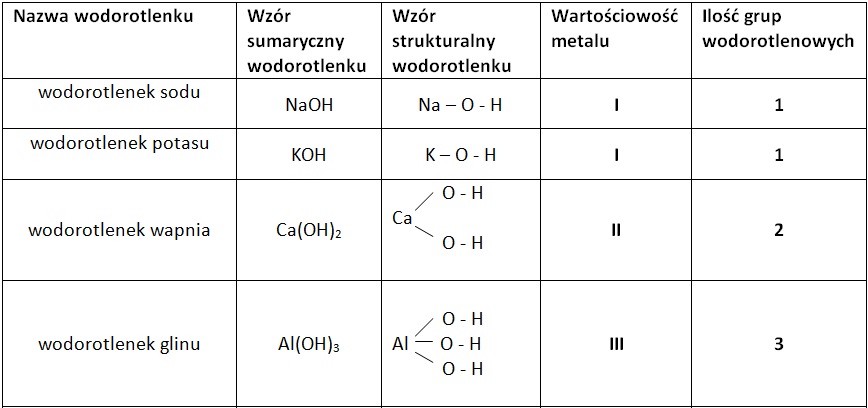
Spójrz na wzór NaOH (wodorotlenek sodu). Na to symbol sodu (Na) i symbol grupy wodorotlenowej (OH).
Kluczowe jest połączenie metalu i grupy OH.
Podział wodorotlenków
Wodorotlenki dzielimy na rozpuszczalne i nierozpuszczalne w wodzie.
Rozpuszczalne wodorotlenki tworzą zasady.
Wyobraź sobie cukier w herbacie – rozpuszcza się, prawda? Podobnie niektóre wodorotlenki.
Wodorotlenki rozpuszczalne - zasady
Zasady to wodorotlenki metali grup 1 i 2 układu okresowego (z wyjątkiem berylu i magnezu).
Litowce i berylowce – to gwiazdy wśród wodorotlenków, bo tworzą zasady.
NaOH (wodorotlenek sodu) – silna zasada, używana np. do produkcji mydła.
KOH (wodorotlenek potasu) – kolejna silna zasada, stosowana w akumulatorach alkalicznych.
Roztwory zasad są śliskie w dotyku i barwią wskaźniki.
Pomyśl o mydle – jest śliskie, bo zawiera zasady.
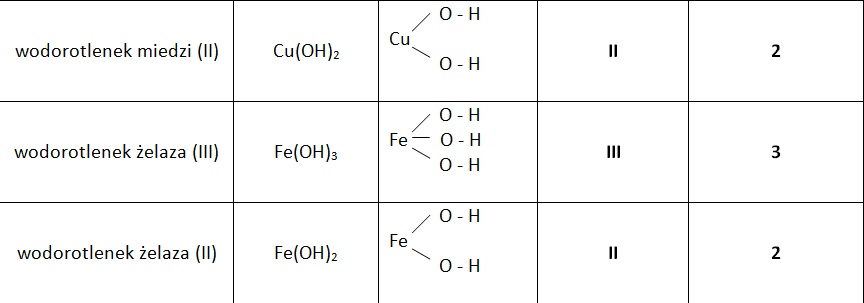
Wodorotlenki nierozpuszczalne
Wodorotlenki nierozpuszczalne tworzą osady.
Wyobraź sobie piasek w wodzie – nie rozpuszcza się, tylko opada na dno. Tak samo wodorotlenki nierozpuszczalne.
Cu(OH)2 (wodorotlenek miedzi(II)) – niebieski osad.
Fe(OH)3 (wodorotlenek żelaza(III)) – rdzawy osad.
Te wodorotlenki są "nieśmiałe" i nie chcą się rozpuszczać.
Właściwości wodorotlenków
Właściwości wodorotlenków zależą od tego, czy są rozpuszczalne, czy nie.
Jak różnią się słodkie i słone potrawy? Podobnie jest z wodorotlenkami.
Właściwości zasad
Zasady mają pH powyżej 7.
Wyobraź sobie skalę pH jak termometr – zasady wskazują wyższą temperaturę (pH).
Barwią wskaźniki (np. lakmus na niebiesko, fenoloftaleinę na malinowo).
Wskaźniki są jak sygnalizatory – pokazują, czy mamy do czynienia z zasadą.
Reagują z kwasami, tworząc sól i wodę (reakcja zobojętniania).
Zasady neutralizują kwasy, jak antidotum na truciznę.
Właściwości wodorotlenków nierozpuszczalnych
Nie barwią wskaźników.
Są obojętne dla wskaźników, nie dają żadnego sygnału.
Reagują z kwasami.
Mogą ulegać rozkładowi pod wpływem temperatury.
Podgrzewanie to jak wyzwanie – niektóre wodorotlenki tego nie wytrzymują.
Otrzymywanie wodorotlenków
Wodorotlenki można otrzymać na różne sposoby.
To jak przepisy na ciasto – różne składniki i metody, ale efekt ten sam.
Reakcja metalu z wodą
Metale aktywne (np. sód, potas) reagują z wodą, tworząc wodorotlenek i wodór.
To jak wybuchowa mieszanka – metal + woda = wodorotlenek + dużo energii!
2Na + 2H2O → 2NaOH + H2
Reakcja tlenku metalu z wodą
Tlenki metali aktywnych reagują z wodą, tworząc wodorotlenek.
Tlenek metalu + woda = spokojniejsza reakcja, niż poprzednia.
CaO + H2O → Ca(OH)2
Reakcja soli z zasadą
Reakcja soli z zasadą prowadzi do wytrącenia wodorotlenku nierozpuszczalnego.
Sól + zasada = wodorotlenek + nowa sól (często osad).
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Zastosowanie wodorotlenków
Wodorotlenki mają szerokie zastosowanie w przemyśle i życiu codziennym.
To jak uniwersalne narzędzia – przydają się w wielu sytuacjach.
- Wodorotlenek sodu (NaOH) – produkcja mydła, papieru, środków czyszczących.
- Wodorotlenek wapnia (Ca(OH)2) – budownictwo (zaprawa murarska), rolnictwo (wapnowanie gleby).
- Wodorotlenek magnezu (Mg(OH)2) – leki na zgagę.
To tylko kilka przykładów, wodorotlenki są wszędzie!
Mam nadzieję, że ta podróż po świecie wodorotlenków była dla Ciebie pouczająca i zrozumiała.
Pamiętaj, chemia to fascynująca dziedzina, pełna niespodzianek!