Chemia w klasie 8 to niezwykle ważny etap w nauce o otaczającym nas świecie. To wtedy zaczynamy głębiej rozumieć budowę materii, reakcje chemiczne i prawa, które nimi rządzą. Przystępując do testu z chemii w klasie 8, warto przypomnieć sobie kilka kluczowych zagadnień.
Budowa Atomu i Układ Okresowy Pierwiastków
Podstawą chemii jest zrozumienie, z czego zbudowane są substancje. Wszystko składa się z atomów. Atom to najmniejsza część pierwiastka chemicznego, która zachowuje jego właściwości. Atomy składają się z trzech rodzajów cząstek elementarnych: protonów, neutronów i elektronów.
- Protony: Znajdują się w jądrze atomowym i mają ładunek dodatni (+). Liczba protonów w jądrze atomu określa liczbę atomową pierwiastka (Z).
- Neutrony: Również znajdują się w jądrze atomowym, ale nie posiadają ładunku elektrycznego (są obojętne). Liczba protonów i neutronów w jądrze atomowym określa liczbę masową pierwiastka (A).
- Elektrony: Krążą wokół jądra atomowego po określonych orbitalach (poziomach energetycznych) i mają ładunek ujemny (-). Liczba elektronów w atomie obojętnym jest równa liczbie protonów.
Układ Okresowy Pierwiastków (UOP) to tabela, w której pierwiastki są uporządkowane według rosnącej liczby atomowej. UOP pozwala przewidywać właściwości pierwiastków i związków chemicznych. W UOP pierwiastki są ułożone w grupy (kolumny pionowe) i okresy (rzędy poziome). Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, ponieważ posiadają taką samą liczbę elektronów walencyjnych (elektronów na ostatniej powłoce).
Przykład: Rozważmy atom węgla (C). Ma on liczbę atomową Z = 6 i liczbę masową A = 12. Oznacza to, że w jądrze atomu węgla znajduje się 6 protonów i 6 neutronów, a wokół jądra krąży 6 elektronów. Węgiel znajduje się w 14 grupie i 2 okresie UOP.
Wiązania Chemiczne
Atomy łączą się ze sobą, tworząc cząsteczki i związki chemiczne, dzięki wiązaniom chemicznym. Istnieją różne rodzaje wiązań, a najważniejsze z nich to:
- Wiązanie kowalencyjne: Powstaje, gdy atomy uwspólniają pary elektronowe. Ten typ wiązania występuje najczęściej między atomami niemetali. Przykład: W cząsteczce wody (H2O) atom tlenu uwspólnia po jednym elektronie z każdym atomem wodoru.
- Wiązanie jonowe: Powstaje, gdy atom oddaje elektron innemu atomowi, tworząc jony – cząstki naładowane elektrycznie. Wiązanie jonowe występuje najczęściej między metalami i niemetalami. Przykład: W chlorku sodu (NaCl) atom sodu (metal) oddaje elektron atomowi chloru (niemetal).
- Wiązanie metaliczne: Występuje w metalach i polega na uwspólnieniu elektronów walencyjnych przez wszystkie atomy metalu. Elektrony te poruszają się swobodnie po całej strukturze metalu, co tłumaczy jego dobre przewodnictwo elektryczne i cieplne.
Reakcje Chemiczne
Reakcja chemiczna to proces, w którym jedne substancje (substraty) przekształcają się w inne substancje (produkty). Reakcje chemiczne można zapisywać za pomocą równań chemicznych. Równanie chemiczne musi być uzgodnione, czyli liczba atomów każdego pierwiastka po stronie substratów musi być równa liczbie atomów tego samego pierwiastka po stronie produktów. Do uzgadniania równań chemicznych używamy współczynników stechiometrycznych.
Przykład: Spalanie metanu (CH4) w tlenie (O2) to reakcja chemiczna, w której powstaje dwutlenek węgla (CO2) i woda (H2O). Uzgodnione równanie tej reakcji wygląda następująco:
CH4 + 2O2 → CO2 + 2H2O
W tym równaniu: 1 cząsteczka metanu reaguje z 2 cząsteczkami tlenu, dając 1 cząsteczkę dwutlenku węgla i 2 cząsteczki wody.
Reakcje chemiczne dzielimy na różne typy, m.in.:
- Reakcje syntezy: Dwa lub więcej substratów łączy się, tworząc jeden produkt. Przykład: 2H2 + O2 → 2H2O
- Reakcje analizy (rozkładu): Jeden substrat rozpada się na dwa lub więcej produktów. Przykład: 2H2O → 2H2 + O2
- Reakcje wymiany: Jeden pierwiastek wypiera inny z związku chemicznego.
Roztwory
Roztwór to jednorodna mieszanina dwóch lub więcej substancji. Roztwór składa się z rozpuszczalnika (substancji, w której rozpuszczamy inne substancje) i substancji rozpuszczonej. Najczęściej rozpuszczalnikiem jest woda.
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości rozpuszczalnika lub roztworu. Stężenie roztworu można wyrażać na różne sposoby, np.:
- Stężenie procentowe: Określa masę substancji rozpuszczonej w 100 gramach roztworu.
- Stężenie molowe: Określa liczbę moli substancji rozpuszczonej w 1 litrze roztworu.
Rozpuszczalność substancji to maksymalna ilość tej substancji, która może rozpuścić się w danej ilości rozpuszczalnika w danej temperaturze.
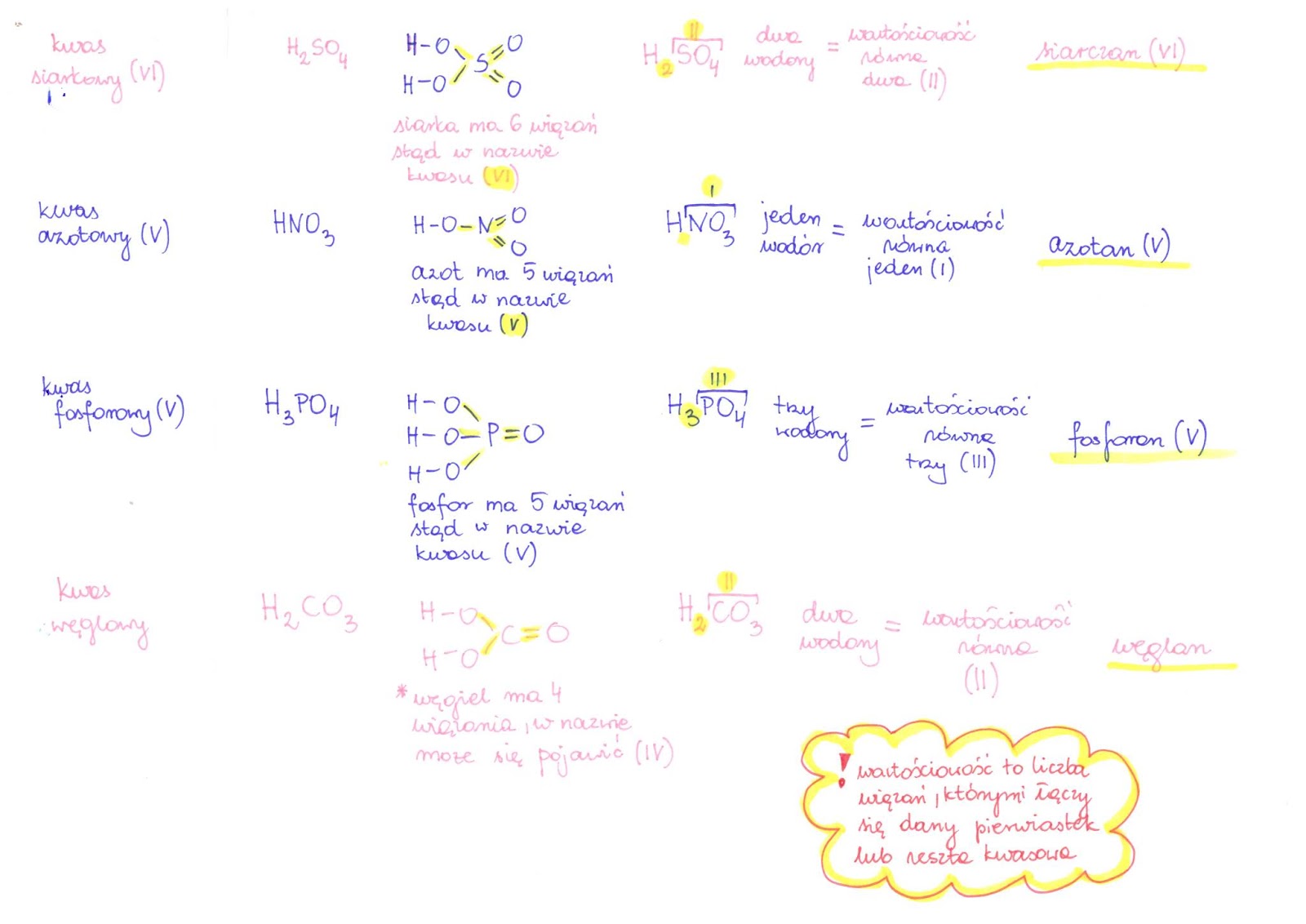
Kwasy i Zasady
Kwasy to związki chemiczne, które w roztworach wodnych dysocjują na jony wodorowe (H+) i aniony. Kwasy mają kwaśny smak (ostrożnie! nie wolno smakować odczynników chemicznych!), powodują korozję metali i zmieniają barwę wskaźników (np. lakmusu na czerwono).
Zasady to związki chemiczne, które w roztworach wodnych dysocjują na jony wodorotlenkowe (OH-) i kationy. Zasady mają gorzki smak, są śliskie w dotyku i zmieniają barwę wskaźników (np. lakmusu na niebiesko).
Skala pH służy do określania kwasowości lub zasadowości roztworu. Skala pH ma zakres od 0 do 14. Roztwory o pH < 7 są kwaśne, roztwory o pH > 7 są zasadowe, a roztwory o pH = 7 są obojętne.
Reakcja zobojętniania to reakcja między kwasem a zasadą, w wyniku której powstaje sól i woda. Przykład: HCl + NaOH → NaCl + H2O.
Przygotowując się do testu z chemii w klasie 8, warto powtórzyć te zagadnienia i rozwiązać jak najwięcej zadań. Powodzenia!