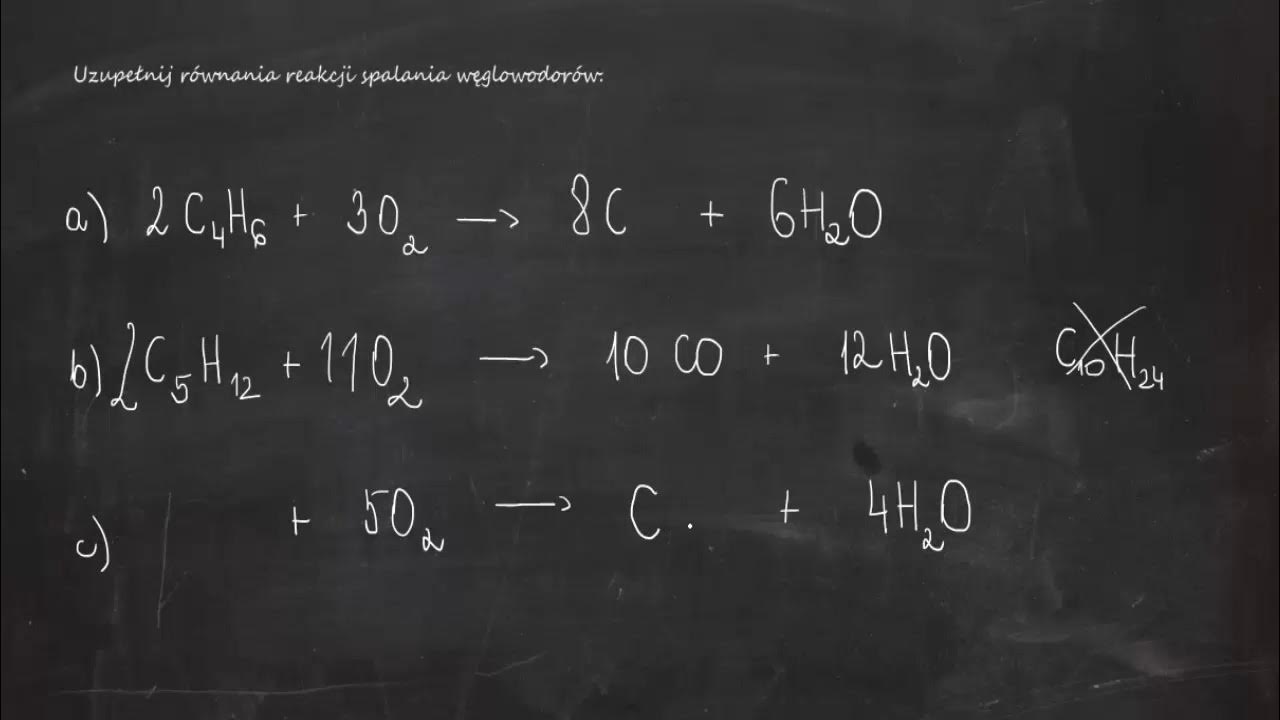Hej uczniowie! Przygotujcie się na fascynującą podróż do świata węglowodorów! Rozłożymy ten temat na czynniki pierwsze, tak abyście bez problemu poradzili sobie z zadaniami i zrozumieli, o co w tym wszystkim chodzi.
Czym są węglowodory?
Węglowodory to związki chemiczne, które składają się wyłącznie z dwóch rodzajów atomów: węgla (C) i wodoru (H). To tak jakby budowla zbudowana tylko z dwóch rodzajów klocków. Ważne jest, że niczego innego tam nie znajdziemy - tylko węgiel i wodór!
To są podstawowe składniki wielu substancji, które spotykamy na co dzień. Od gazu ziemnego, który ogrzewa nasze domy, po benzynę, którą tankujemy do samochodów. Węglowodory są wszechobecne!
Dlaczego są tak ważne?
Węglowodory są bardzo ważne, ponieważ stanowią główne źródło energii. Kiedy je spalamy, uwalnia się energia w postaci ciepła, które możemy wykorzystać do różnych celów. Ponadto, są one surowcem do produkcji wielu innych substancji, takich jak tworzywa sztuczne, leki i nawozy.
Podział węglowodorów
Węglowodory dzielimy na różne grupy, w zależności od budowy ich cząsteczek. Najważniejsze podziały to:
- Węglowodory alifatyczne (inaczej łańcuchowe)
- Węglowodory aromatyczne
Węglowodory alifatyczne
Węglowodory alifatyczne charakteryzują się tym, że atomy węgla tworzą łańcuchy. Mogą to być łańcuchy proste, rozgałęzione lub pierścieniowe (ale nie aromatyczne). W obrębie węglowodorów alifatycznych wyróżniamy:
- Alkany
- Alkeny
- Alkiny
Alkany
Alkany to najprostsze węglowodory alifatyczne. Mają one tylko pojedyncze wiązania między atomami węgla. Możemy je zapisać ogólnym wzorem: CnH2n+2, gdzie n to liczba atomów węgla.
Przykłady alkanów to: metan (CH4), etan (C2H6), propan (C3H8) i butan (C4H10). Metan jest głównym składnikiem gazu ziemnego. Butan znajdziemy w zapalniczkach.
Nazwy alkanów tworzymy dodając końcówkę "-an" do rdzenia, który pochodzi od greckiej lub łacińskiej nazwy liczby atomów węgla w cząsteczce. Na przykład, "meta-" oznacza jeden atom węgla, "eta-" dwa atomy węgla, "propa-" trzy atomy węgla, a "buta-" cztery atomy węgla.
Alkeny
Alkeny to węglowodory alifatyczne, które zawierają jedno wiązanie podwójne między atomami węgla. Mają one ogólny wzór: CnH2n. Ze względu na obecność wiązania podwójnego, alkeny są bardziej reaktywne niż alkany.
Przykładem alkenu jest eten (C2H4), znany również jako etylen. Eten jest wykorzystywany do produkcji tworzyw sztucznych, np. polietylenu, z którego robi się folię i butelki.
Nazwy alkenów tworzymy podobnie jak alkanów, ale zamiast końcówki "-an" używamy końcówki "-en". Na przykład, eten, propen, buten.
Alkiny
Alkiny to węglowodory alifatyczne, które zawierają jedno wiązanie potrójne między atomami węgla. Mają one ogólny wzór: CnH2n-2. Wiązanie potrójne sprawia, że alkiny są jeszcze bardziej reaktywne niż alkeny.
Przykładem alkinu jest etyn (C2H2), znany również jako acetylen. Acetylen jest wykorzystywany w palnikach acetylenowo-tlenowych do spawania i cięcia metali, ponieważ podczas jego spalania wydziela się bardzo wysoka temperatura.
Nazwy alkinów tworzymy podobnie jak alkanów i alkenów, ale zamiast końcówek "-an" i "-en" używamy końcówki "-in". Na przykład, etyn, propin, butin.
Węglowodory aromatyczne
Węglowodory aromatyczne to związki, które zawierają pierścień aromatyczny. Najprostszym i najbardziej znanym węglowodorem aromatycznym jest benzen (C6H6).
Cząsteczka benzenu ma sześć atomów węgla ułożonych w pierścień, a każdy atom węgla jest połączony z jednym atomem wodoru. Wiązania między atomami węgla w pierścieniu benzenowym są szczególne – nie są ani pojedyncze, ani podwójne, ale pośrednie. Mówimy, że elektrony są zdelokalizowane w całym pierścieniu, co nadaje benzenowi szczególną stabilność.
Węglowodory aromatyczne są wykorzystywane do produkcji wielu substancji, takich jak leki, barwniki i tworzywa sztuczne.
Reakcje węglowodorów
Węglowodory, zwłaszcza alkany, są stosunkowo niereaktywne. Niemniej jednak, mogą ulegać pewnym reakcjom, z których najważniejszą jest spalanie.
Spalanie
Spalanie to reakcja węglowodoru z tlenem, w wyniku której powstaje dwutlenek węgla (CO2) i woda (H2O), a także wydziela się energia w postaci ciepła i światła.
Spalanie może być całkowite lub niecałkowite. Spalanie całkowite zachodzi wtedy, gdy mamy wystarczającą ilość tlenu. Wtedy produktami są tylko dwutlenek węgla i woda. Spalanie niecałkowite zachodzi, gdy tlenu jest za mało. Wtedy, oprócz dwutlenku węgla i wody, powstaje również tlenek węgla (CO) lub sadza (C). Tlenek węgla jest bardzo trujący!
Przykład spalania całkowitego metanu: CH4 + 2O2 → CO2 + 2H2O
Przykład spalania niecałkowitego metanu (z niedoborem tlenu): 2CH4 + 3O2 → 2CO + 4H2O
Izomeria
Izomeria to zjawisko występowania związków chemicznych o tym samym wzorze sumarycznym, ale różnej budowie. Takie związki nazywamy izomerami. Izomery mają różne właściwości fizyczne i chemiczne.
Na przykład, butan (C4H10) ma dwa izomery: n-butan (łańcuch prosty) i izobutan (łańcuch rozgałęziony).
Podsumowanie
Węglowodory to fascynująca grupa związków chemicznych, która odgrywa kluczową rolę w naszym życiu. Teraz znacie już ich podział, podstawowe właściwości i reakcje. Mam nadzieję, że ten artykuł pomógł Wam zrozumieć ten temat! Powodzenia na sprawdzianach!