Hej ósmoklasisto! Przygotowujesz się do sprawdzianu z kwasów? Super! Ten przewodnik pomoże Ci uporządkować wiedzę.
Co to są kwasy?
Kwasy to związki chemiczne. Mają charakterystyczne właściwości.
Właściwości kwasów
Kwasy mają kwaśny smak. Pamiętaj, żeby nigdy nie smakować kwasów w laboratorium! Są żrące.
Kwasy reagują z metalami. Powstają wtedy sole i wodór.
Kwasy zmieniają barwę wskaźników. Na przykład, lakmus zmienia kolor na czerwony.
Kwasy reagują z zasadami. Mówimy wtedy o reakcji zobojętniania. Powstaje sól i woda.
Podział kwasów
Kwasy dzielimy na różne sposoby. Najpopularniejszy podział to:
Kwasy beztlenowe
To kwasy, które w swojej budowie nie zawierają atomów tlenu. Składają się z wodoru i niemetalu.
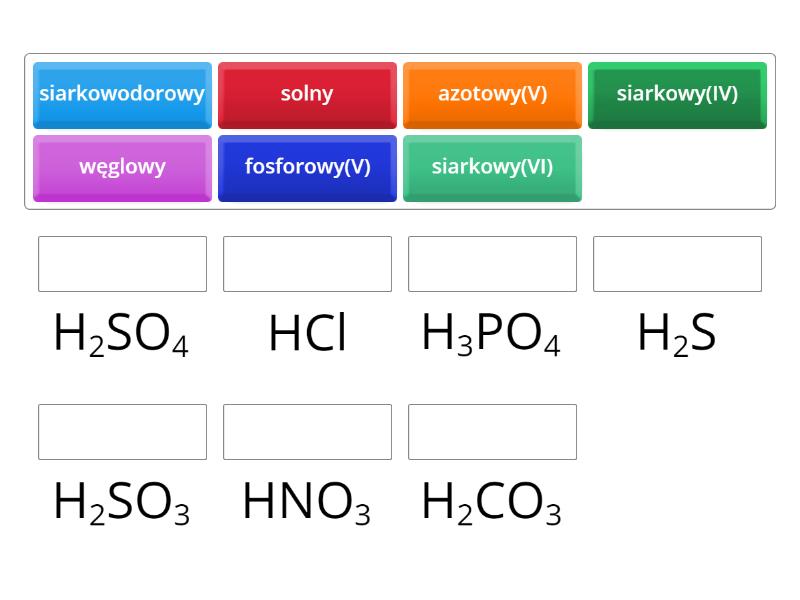
Przykłady kwasów beztlenowych: kwas chlorowodorowy (HCl), kwas siarkowodorowy (H2S).
Nazwa kwasu beztlenowego tworzona jest od nazwy niemetalu z dodatkiem słowa "kwas" i końcówki "-wodorowy".
Na przykład: chlor + kwas + -wodorowy = kwas chlorowodorowy.
Kwasy tlenowe (oksykwasy)
To kwasy, które zawierają atomy tlenu w swojej budowie. Składają się z wodoru, niemetalu i tlenu.
Przykłady kwasów tlenowych: kwas siarkowy(VI) (H2SO4), kwas azotowy(V) (HNO3), kwas węglowy (H2CO3).
Nazwa kwasu tlenowego tworzona jest od nazwy niemetalu z dodatkiem słowa "kwas" i odpowiedniej końcówki. Końcówka zależy od stopnia utlenienia niemetalu.
Najczęściej spotykane końcówki to: -owy (dla wyższych stopni utlenienia) i -awy (dla niższych stopni utlenienia).
Na przykład: kwas siarkowy(VI), kwas azotowy(V), kwas siarkawy(IV).
Wzory sumaryczne kwasów
Wzór sumaryczny kwasu informuje nas o liczbie i rodzaju atomów, które wchodzą w skład cząsteczki kwasu.
HCl - kwas chlorowodorowy. Jedna cząsteczka składa się z jednego atomu wodoru i jednego atomu chloru.
H2SO4 - kwas siarkowy(VI). Jedna cząsteczka składa się z dwóch atomów wodoru, jednego atomu siarki i czterech atomów tlenu.
Pamiętaj o poprawnym zapisywaniu indeksów dolnych!
Dysocjacja jonowa kwasów
Dysocjacja jonowa to rozpad związku chemicznego na jony pod wpływem wody. Kwasy ulegają dysocjacji jonowej, tworząc kationy wodoru (H+) i aniony reszty kwasowej.
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
Kationy wodoru odpowiadają za kwaśny odczyn roztworu.
Sole kwasów
Sole to związki chemiczne powstałe w wyniku zastąpienia atomów wodoru w kwasie przez atomy metalu. Mogą powstać w reakcji kwasu z metalem, zasadą lub tlenkiem metalu.
Przykłady soli: NaCl (chlorek sodu), CaSO4 (siarczan(VI) wapnia), KNO3 (azotan(V) potasu).
Nazwy soli tworzymy od nazwy kwasu, od którego pochodzi. Na przykład, sól pochodząca od kwasu chlorowodorowego to chlorek.
Reakcja kwasu z metalem: 2HCl + Mg → MgCl2 + H2
Reakcja kwasu z zasadą (reakcja zobojętniania): HCl + NaOH → NaCl + H2O
Wskaźniki
Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Pomagają nam określić, czy dany roztwór ma odczyn kwasowy, zasadowy czy obojętny.
Przykłady wskaźników:
- Lakmus: w roztworze kwasowym - czerwony, w roztworze zasadowym - niebieski, w roztworze obojętnym - fioletowy.
- Fenoloftaleina: w roztworze kwasowym - bezbarwna, w roztworze zasadowym - malinowa, w roztworze obojętnym - bezbarwna.
- Oranż metylowy: w roztworze kwasowym - czerwony, w roztworze zasadowym - żółty, w roztworze obojętnym - pomarańczowy.
- Uniwersalny papierek wskaźnikowy: daje szeroką gamę kolorów w zależności od pH roztworu.
Zastosowanie kwasów
Kwasy mają szerokie zastosowanie w różnych dziedzinach życia.
- Kwas siarkowy(VI) (H2SO4): produkcja nawozów, detergentów, tworzyw sztucznych.
- Kwas chlorowodorowy (HCl): produkcja leków, oczyszczanie metali.
- Kwas azotowy(V) (HNO3): produkcja nawozów, materiałów wybuchowych.
- Kwas octowy (CH3COOH): konserwant żywności, produkcja tworzyw sztucznych.
Bezpieczeństwo pracy z kwasami
Praca z kwasami wymaga zachowania szczególnej ostrożności. Kwasy są żrące i mogą powodować oparzenia.
- Zawsze używaj okularów ochronnych i rękawic.
- Pracuj w dobrze wentylowanym pomieszczeniu.
- W razie kontaktu kwasu ze skórą, natychmiast spłucz dużą ilością wody.
- Nigdy nie dodawaj wody do stężonego kwasu! Zawsze wlewaj kwas do wody powoli i mieszając.
Podsumowanie
Zapamiętaj najważniejsze informacje:
- Kwasy mają kwaśny smak i żrące właściwości.
- Dzielimy je na beztlenowe i tlenowe.
- Ulegają dysocjacji jonowej, tworząc kationy wodoru.
- Reagują z metalami i zasadami (reakcja zobojętniania).
- Zmieniają barwę wskaźników.
- Mają szerokie zastosowanie w przemyśle i życiu codziennym.
- Należy zachować szczególną ostrożność podczas pracy z kwasami.
Powodzenia na sprawdzianie! Pamiętaj, żeby dokładnie przeczytać pytania i spokojnie odpowiedzieć. Dasz radę!