Hej! W klasie ósmej chemia może wydawać się jak labirynt pełen wzorów i tajemniczych reakcji. Ale spokojnie, razem przejdziemy przez to krok po kroku, używając obrazów i przykładów, które pomogą Ci wszystko zrozumieć. Przygotuj się na chemiczną podróż!
Atomy i Pierwiastki: Budulce Wszechświata
Wyobraź sobie, że świat jest zbudowany z LEGO. Każdy klocek to inny rodzaj atomu. A te klocki, posegregowane i uporządkowane, to właśnie pierwiastki, które znajdziesz w układzie okresowym pierwiastków. Układ okresowy to taka wielka, kolorowa instrukcja obsługi tych klocków.
Każdy pierwiastek ma swoje miejsce w układzie, oznaczone symbolem (np. H dla wodoru, O dla tlenu). Ten symbol to skrócona nazwa pierwiastka, jak Twój skrócony pseudonim w grze. Spójrz na układ okresowy jak na mapę skarbów - każdy symbol prowadzi do cennego pierwiastka.
Atom składa się z jeszcze mniejszych części: protonów (ładunek dodatni), neutronów (bez ładunku) i elektronów (ładunek ujemny). Wyobraź sobie Słońce (jądro atomu z protonami i neutronami) i planety krążące wokół niego (elektrony). Protony i neutrony siedzą "w słoneczku", a elektrony pędzą po orbitach.
Liczba atomowa, widoczna w układzie okresowym, to liczba protonów w jądrze atomu. To numer identyfikacyjny każdego pierwiastka. Tlen ma numer 8, co oznacza, że ma 8 protonów. To jak numer na koszulce ulubionego piłkarza – od razu wiesz, o kogo chodzi!
Związki Chemiczne: Klocki połączone w budowle
Kiedy atomy zaczynają się łączyć, tworzą związki chemiczne. To tak, jakby klocki LEGO łączyły się w domy, samochody i inne budowle. Najbardziej znanym przykładem jest woda (H2O). Dwa atomy wodoru łączą się z jednym atomem tlenu, tworząc cząsteczkę wody. Wyobraź sobie dwa małe klocki wodoru przyczepione do większego klocka tlenu.
Sposób, w jaki atomy się łączą, zależy od ich wartościowości, czyli liczby "rączek", którymi mogą się przyłączyć do innych atomów. Pomyśl o wartościowości jak o ilości rzepów na klocku LEGO. Wodór ma jedną "rączkę", tlen ma dwie. Dlatego potrzebne są dwa wodory, żeby "zapełnić" wszystkie "rączki" tlenu.
Wzór chemiczny związku pokazuje, jakie atomy i w jakiej ilości tworzą ten związek. CO2 (dwutlenek węgla) oznacza, że jeden atom węgla łączy się z dwoma atomami tlenu. To jak przepis na ciasto – mówi, ile czego potrzebujesz, żeby je upiec!
Reakcje Chemiczne: Przemiany Materii
Reakcja chemiczna to przemiana jednych substancji (substratów) w inne (produkty). To jak gotowanie – mieszając składniki (substraty) i podgrzewając je, otrzymujesz nowe danie (produkt).
Na przykład, spalanie drewna to reakcja chemiczna. Drewno (węgiel) łączy się z tlenem z powietrza (substraty), a powstaje dwutlenek węgla, woda i energia (ciepło i światło) (produkty). Wyobraź sobie ognisko - drewno znika, pojawia się dym i ciepło!
Równanie reakcji chemicznej to zapis tej przemiany, z użyciem wzorów chemicznych. Musi być uzgodnione, czyli liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania. To jak bilans – musisz mieć tyle samo "kasy" po stronie przychodów i wydatków.
Przykłady reakcji chemicznych z życia codziennego: oddychanie (tlen + glukoza -> dwutlenek węgla + woda), rdzewienie żelaza (żelazo + tlen -> tlenek żelaza), pieczenie ciasta (składniki -> ciasto).
Kwasy i Zasady: Smaki Chemii
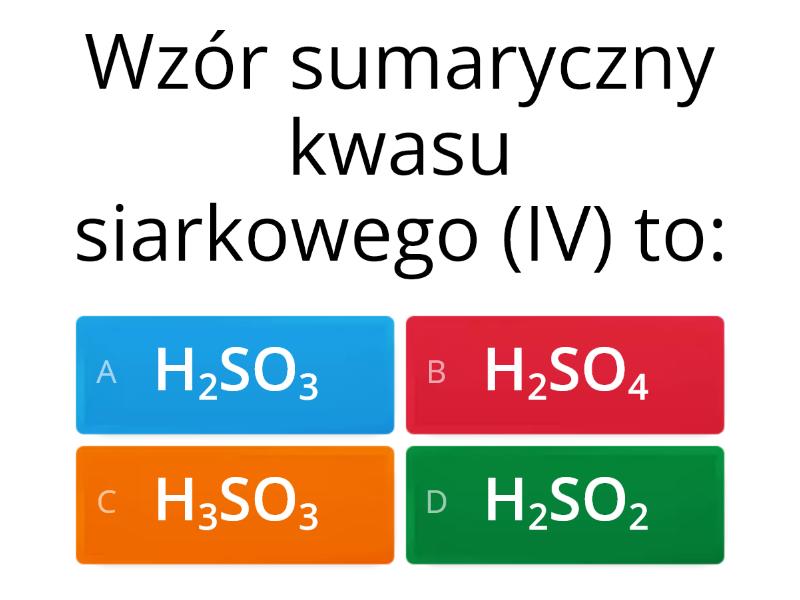
Kwasy i zasady to dwie przeciwstawne grupy związków chemicznych. Pomyśl o nich jak o przeciwieństwach – jak plus i minus. Kwasy mają kwaśny smak (np. sok z cytryny), a zasady są często śliskie w dotyku (np. mydło).
Skala pH służy do określania, czy dana substancja jest kwasem, zasadą, czy jest obojętna. Skala ma wartości od 0 do 14. pH=7 to odczyn obojętny (np. czysta woda). pH < 7 to odczyn kwaśny, a pH > 7 to odczyn zasadowy. Wyobraź sobie termometr – im niższa temperatura, tym zimniej, im wyższe pH, tym bardziej zasadowo.
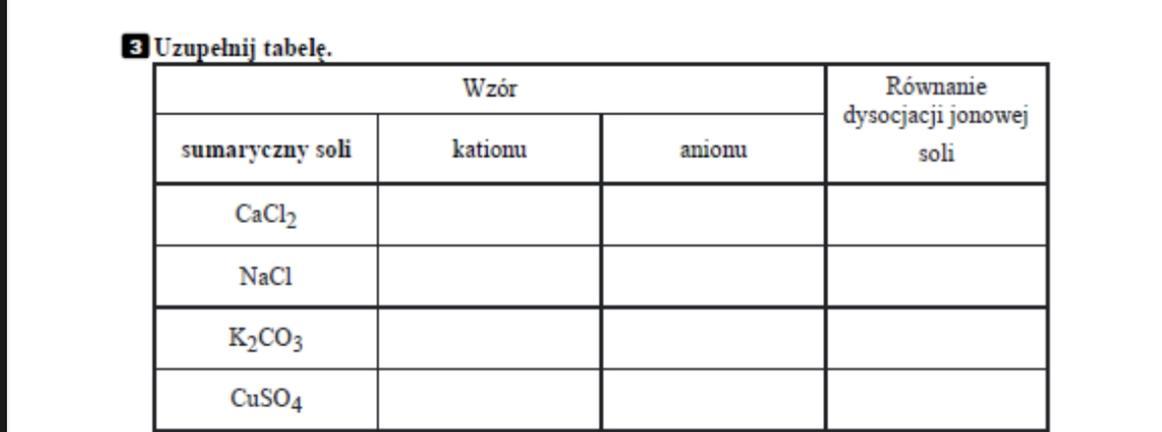
Reakcja neutralizacji to reakcja kwasu z zasadą, w wyniku której powstaje sól i woda. To tak, jakby plus i minus się spotkały i zneutralizowały – napięcie znika. Przykład: kwas solny (HCl) + wodorotlenek sodu (NaOH) -> chlorek sodu (NaCl – sól kuchenna) + woda (H2O).
Mam nadzieję, że teraz chemia w klasie ósmej wyda Ci się trochę bardziej przyjazna. Pamiętaj, żeby wizualizować sobie atomy, związki i reakcje. Powodzenia!