Chemia może wydawać się skomplikowana, ale tak naprawdę bazuje na prostych fundamentach. Dwa z tych fundamentów to symbole pierwiastków i wartościowość. Zrozumienie ich jest kluczowe do dalszej nauki chemii. Przygotuj się na krótką, ale treściwą podróż po świecie atomów i ich łączenia się!
Symbole Pierwiastków – Krótkie Nazwy dla Atomów
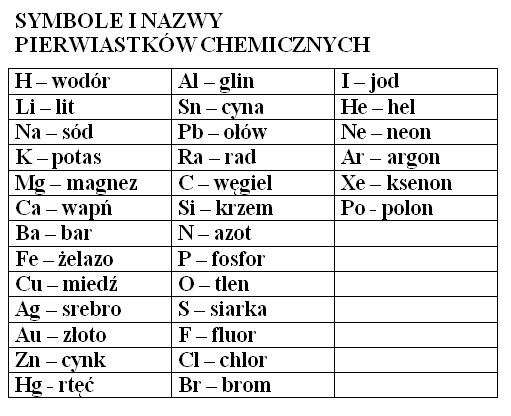
Każdy pierwiastek chemiczny ma swój unikalny symbol. Pomyśl o tym jak o skrócie jego długiej nazwy. Dzięki symbolom chemicy mogą zapisywać reakcje i wzory chemiczne w szybki i efektywny sposób. Wyobraź sobie, że zamiast pisać "woda", moglibyśmy użyć tylko "H2O" – o wiele krócej, prawda?
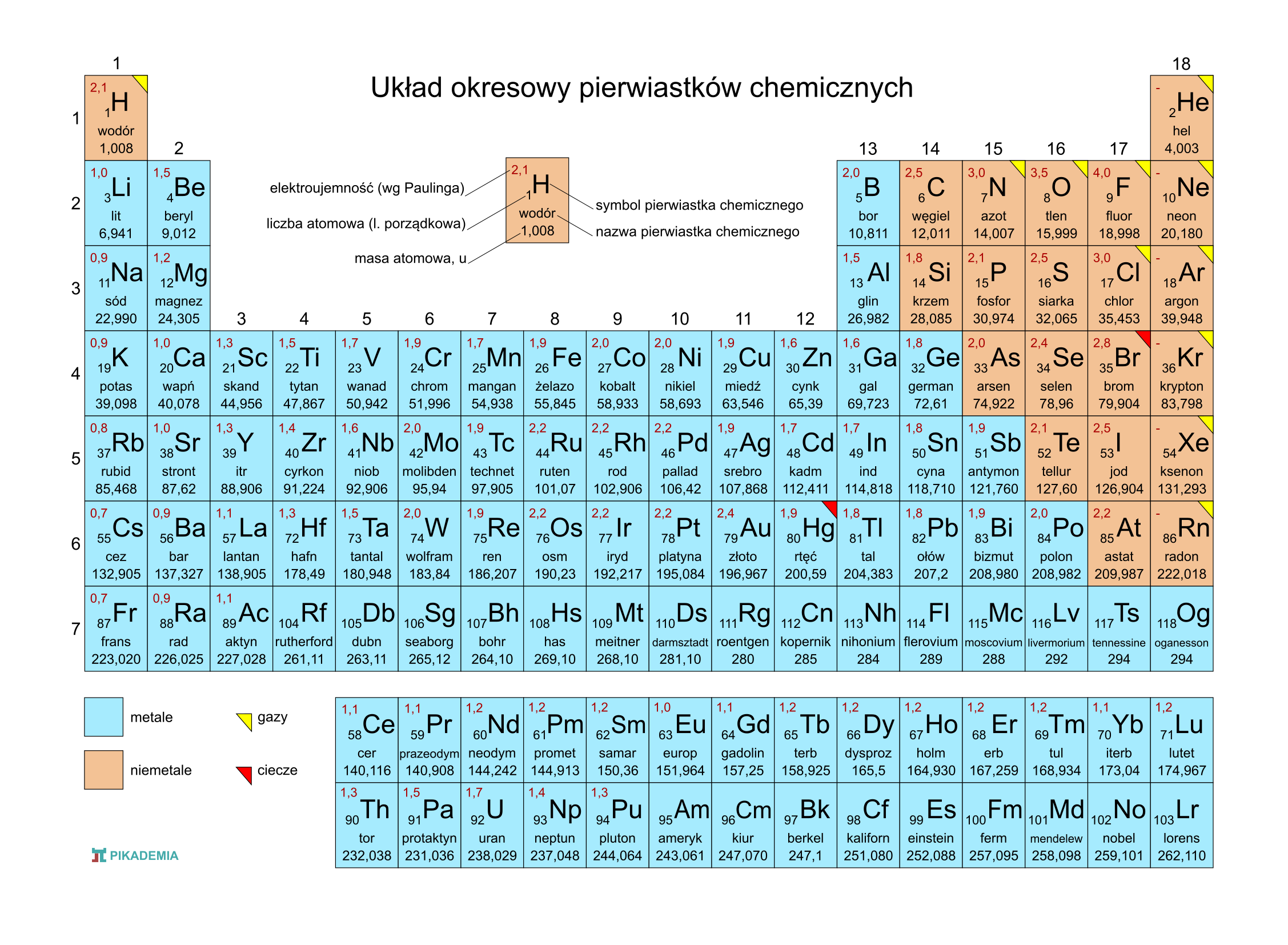
Symbole pierwiastków najczęściej składają się z jednej lub dwóch liter. Pierwsza litera jest zawsze pisana wielką literą, a druga (jeśli występuje) małą literą. Na przykład, H to symbol wodoru, O to symbol tlenu, a He to symbol helu. Niektóre symbole pochodzą od łacińskich nazw pierwiastków, np. Fe to symbol żelaza (od łac. ferrum), a Na to symbol sodu (od łac. natrium). Poznanie tych symboli jest pierwszym krokiem do "czytania" chemicznego języka. Pamiętaj, regularne powtarzanie i używanie symboli w ćwiczeniach sprawi, że szybko je zapamiętasz.
Najważniejsze Symbole do Zapamiętania
Oto kilka symboli pierwiastków, które warto znać na początku:
* H - Wodór (Hydrogenium)
* O - Tlen (Oxygenium)
* N - Azot (Nitrogenium)
* C - Węgiel (Carboneum)
* S - Siarka (Sulfur)
* P - Fosfor (Phosphorus)
* Na - Sód (Natrium)
* K - Potas (Kalium)
* Mg - Magnez (Magnesium)
* Ca - Wapń (Calcium)
* Fe - Żelazo (Ferrum)
* Cl - Chlor (Chlorum)
To takie "alfabet" chemii. Z czasem poznasz ich o wiele więcej, ale te są podstawą. Zwróć uwagę, że niektóre z nich pochodzą od łacińskich nazw. Ucz się ich stopniowo i nie próbuj zapamiętać wszystkiego na raz.
Wartościowość – Ile "rąk" ma Atom?
Wartościowość pierwiastka określa, ile wiązań chemicznych może utworzyć dany atom. Inaczej mówiąc, ile "rąk" ma atom, żeby połączyć się z innymi atomami. Atomy łączą się ze sobą, tworząc cząsteczki, a wartościowość determinuje, w jakich proporcjach to się dzieje. Pomyśl o tym jak o klockach LEGO – niektóre mają jedno wypustki, inne dwie, a jeszcze inne więcej. I tylko odpowiednie klocki pasują do siebie, aby powstała stabilna budowla. Tak samo jest z atomami i ich wartościowościami.
Wartościowość wyrażana jest liczbą naturalną (1, 2, 3 itd.). Pierwiastki o wartościowości 1 mogą utworzyć jedno wiązanie, te o wartościowości 2 – dwa wiązania, i tak dalej. Wartościowość często związana jest z liczbą elektronów walencyjnych, czyli elektronów na ostatniej powłoce elektronowej atomu. Dzięki nim atom łączy się z innymi. Istnieją proste zasady, które pomagają przewidywać wartościowość, ale nie zawsze się one sprawdzają, szczególnie dla pierwiastków bloku d w układzie okresowym.
Przykłady Wartościowości
Zauważ, że niektóre pierwiastki mogą mieć różne wartościowości w różnych związkach. Oto kilka przykładów:
* Wodór (H) – Zazwyczaj wartościowość I. Tworzy jedno wiązanie, np. w wodzie (H₂O) każdy atom wodoru łączy się z atomem tlenu. * Tlen (O) – Zazwyczaj wartościowość II. Tworzy dwa wiązania, np. w wodzie (H₂O) atom tlenu łączy się z dwoma atomami wodoru. * Azot (N) – Może mieć wartościowości od I do V. W amoniaku (NH₃) ma wartościowość III (łączy się z trzema atomami wodoru). * Węgiel (C) – Zazwyczaj wartościowość IV. Tworzy cztery wiązania, np. w metanie (CH₄) atom węgla łączy się z czterema atomami wodoru. * Sód (Na) – Zawsze wartościowość I. Tworzy jedno wiązanie, np. w chlorku sodu (NaCl) łączy się z atomem chloru. * Magnez (Mg) – Zawsze wartościowość II. Tworzy dwa wiązania, np. w tlenku magnezu (MgO) łączy się z atomem tlenu.
Widzimy więc, że wodór i sód mają tylko jedną możliwość połączenia się, a węgiel aż cztery! To dlatego węgiel jest tak ważny w chemii organicznej – tworzy długie i skomplikowane łańcuchy cząsteczek.
Jak Używać Wartościowości do Określania Wzorów Związków
Znajomość wartościowości pomaga w ustalaniu wzorów chemicznych związków. Dla prostych związków dwupierwiastkowych obowiązuje "zasada na krzyż". Polega ona na zapisaniu symboli pierwiastków obok siebie i przypisaniu wartościowości jednego pierwiastka jako indeksu drugiego pierwiastka. Na przykład, aby ustalić wzór tlenku glinu (Al i O), gdzie glin ma wartościowość III, a tlen II, zapisujemy Al₂O₃. Indeksy 2 i 3 pochodzą od wartościowości odpowiednio tlenu i glinu. Upewnij się, że indeksy są w najprostszym możliwym stosunku.
To tylko uproszczenie, ale pozwala zrozumieć podstawowe reguły łączenia się atomów. Pamiętaj, że wzory związków muszą być elektrycznie obojętne, a wartościowość pomaga w osiągnięciu tej równowagi ładunków. Z czasem, wraz z rozwojem wiedzy chemicznej, poznasz bardziej zaawansowane metody określania wzorów związków. Ale znajomość wartościowości jest doskonałym punktem wyjścia.
Wartościowość Złożonych Grup Atomów
Oprócz pojedynczych atomów, także grupy atomów (tzw. rodniki lub jony złożone) mają swoją określoną wartościowość. Na przykład, grupa wodorotlenowa (OH) ma wartościowość I, grupa siarczanowa (SO₄) ma wartościowość II, a grupa fosforanowa (PO₄) ma wartościowość III. Takie grupy atomów często występują w różnych związkach chemicznych i zachowują się jak pojedyncze "cząsteczki" podczas reakcji. Dlatego warto je znać i umieć określić ich wartościowość.
Dzięki znajomości wartościowości rodników, można łatwo ustalać wzory związków chemicznych zawierających te grupy. Na przykład, wodorotlenek sodu (NaOH) powstaje z połączenia jonu sodu (Na⁺) o wartościowości I i jonu wodorotlenowego (OH⁻) o wartościowości I. Siarczan wapnia (CaSO₄) powstaje z połączenia jonu wapnia (Ca²⁺) o wartościowości II i jonu siarczanowego (SO₄²⁻) o wartościowości II. Pamiętaj o zasadzie "na krzyż" – jeśli wartościowości jonów są różne, należy je zamienić miejscami jako indeksy.
Podsumowanie
Symbole pierwiastków i wartościowość to fundamenty chemii. Dzięki nim możemy "czytać" i "pisać" w języku chemicznym. Pamiętaj, że symbole to skróty nazw pierwiastków, a wartościowość to liczba wiązań, jakie atom może utworzyć. Zrozumienie tych pojęć otwiera drzwi do dalszej nauki o związkach chemicznych i reakcjach. Ćwicz regularnie, a chemia stanie się dla Ciebie coraz bardziej zrozumiała i fascynująca.
Nie zrażaj się, jeśli na początku wydaje Ci się to trudne. Chemia to nauka, która wymaga czasu i praktyki. Ale z każdym nowym poznanym symbolem i wartościowością, będziesz coraz bliżej zrozumienia świata cząsteczek i atomów, który nas otacza. Powodzenia!